以 PD-1/PD-L1 为代表的免疫检查点疗法虽已革新了癌症治疗格局,但仅有20%-30%的患者能够从中获益。复杂的肿瘤免疫逃逸机制,如天然免疫信号通路缺陷等,是导致患者治疗无效的重要原因。因此,系统发现能够增强免疫治疗效果、具有转化潜力的新靶点并开发新干预策略,是领域内亟待突破的关键科学问题。
2026年1月8日,北京大学化学与分子工程学院、北大-清华生命科学联合中心雷晓光教授团队与合作者武汉大学医学研究院张金方教授团队在国际顶级肿瘤学期刊《Nature Cancer》杂志上发表了题为“CDK10 suppresses nucleic acid sensors-mediated antitumor immunity”的研究论文。该研究首次揭示了细胞周期蛋白依赖性激酶10(CDK10)在介导肿瘤免疫逃逸中的关键作用,并开发了CDK10的高选择性小分子抑制剂,为克服现有免疫治疗瓶颈提供了新靶点与新策略。

在该研究中,合作团队通过体内激酶组 CRISPR/Cas9 筛选,系统性鉴定出 CDK10 是肿瘤免疫监视的关键负调控因子。功能实验证明其激酶活性是促进免疫逃逸所必需的。多组学分析表明,敲除 CDK10 可重塑肿瘤微环境、增强免疫活化,并依赖 CD8⁺ T 和 NK 细胞抑制肿瘤生长。机制研究发现,CDK10 可磷酸化表观调控因子 DNMT1 和 DNA 损伤修饰因子 RAP80 ,分别抑制细胞中 dsRNA 与 R-loop 积累,从而阻断 MDA5 和 cGAS 介导的天然免疫激活,促进免疫逃逸。
临床分析显示,CDK10 高表达与免疫治疗后不良预后呈正相关,提示其具备作为生物标志物和治疗靶点的潜力。在转化研究方面,利用高通量药物筛选发现临床上已用于治疗白血病的药物 Ponatinib 以及小分子抑制剂NVP-AST487 均能显著抑制 CDK10 活性,并在实体瘤模型中协同增强 PD-1 抑制剂的抗肿瘤疗效。该研究为肿瘤免疫治疗提供了新的思路和候选药物分子。
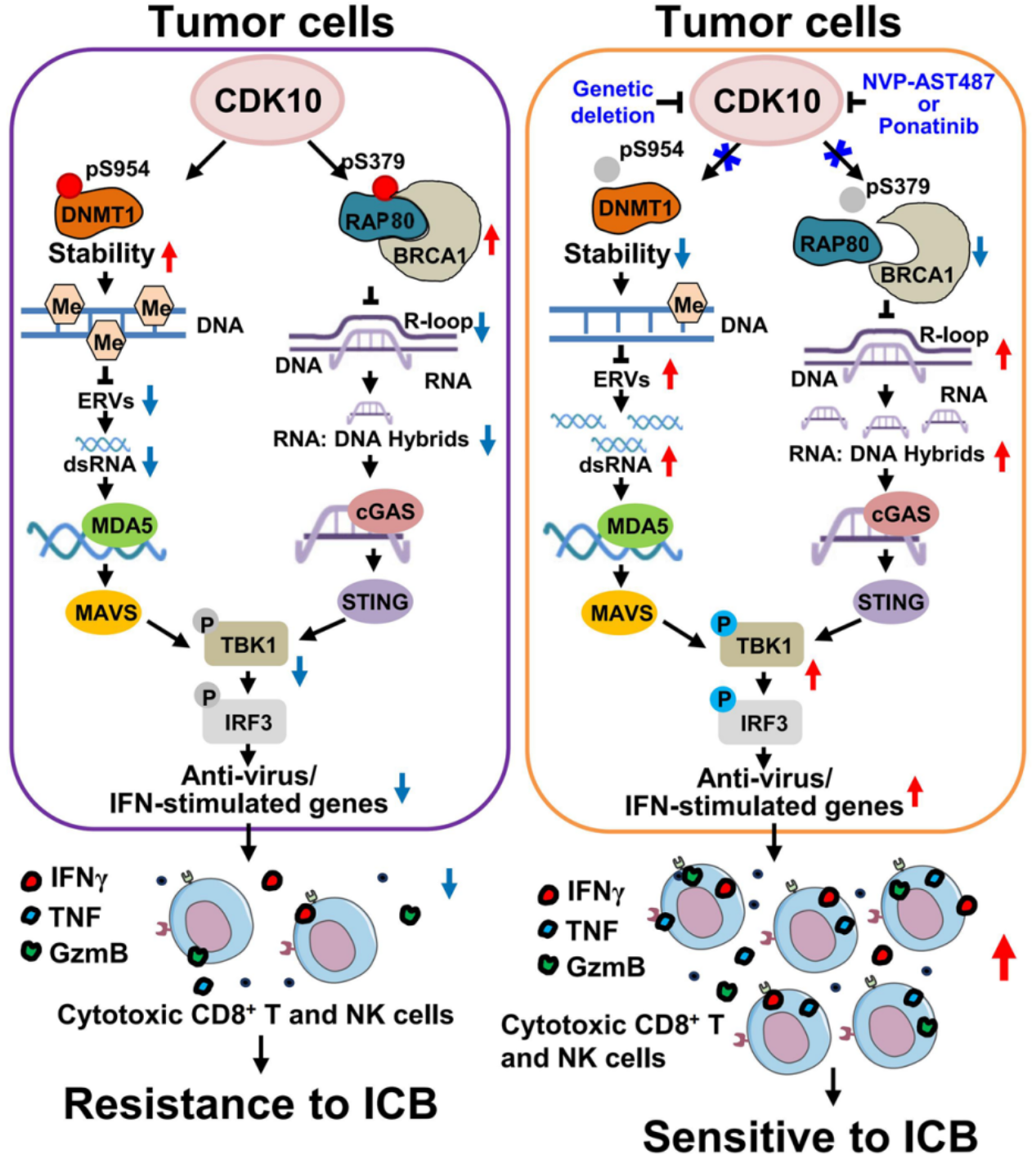
图1:CDK10调控肿瘤免疫逃逸的分子机制及靶向干预策略
武汉大学张金方教授和北京大学雷晓光教授为共同通讯作者。武汉大学医学研究院博士研究生续高山、北京大学郭富生博士、武汉大学医学研究院何川博士以及研究生王希涌为该论文的共同第一作者。该工作得到了科技部国家重点研发计划、国家自然科学基金、国家海外引进高层次人才青年项目,北京分子科学国家研究中心、北大-清华生命科学联合中心,新基石基金会,武汉大学泰康生命医学中心以及复杂生命体代谢与调控重点实验室等项目或单位的资助。
原文链接:https://www.nature.com/articles/s43018-025-01100-3
雷晓光教授在利用化学生物学手段揭示人类重大疾病分子机制、转化医学与创新药物开发领域做出了突出贡献。目前已经在《Science》、《Cell》、《Nature》等高水平学术期刊发表论文180余篇,并且获得了超过20项创新药物发明专利授权。曾获国家杰出青年基金,教育部“长江学者特聘教授”,入选国家万人计划领军人才,入选首批北京市卓越青年科学家计划,获得新基石研究员项目资助。曾作为科技部973、863首席科学家主持承担18项国家重大科研项目。曾荣获科学探索奖,屠呦呦奖、国际四面体青年科学家奖,国际化学生物学协会青年科学家奖,中国化学会-维善天然产物合成奖,中国药学会施维雅药物化学家奖,树兰医学青年奖,药明康德生命化学奖等20项国内外学术奖励。目前兼任国际化学生物学协会国际委员,国际药物化学领域核心期刊《JACS Au》杂志的副主编。课题组长期招聘博士研究生和博士后,热忱欢迎具有生物学、化学、药学、基础医学、合成生物学、生物信息学及人工智能等相关背景的海内外优秀人才加盟。详情介绍见课题组网页(http://www.chem.pku.edu.cn/leigroup/)
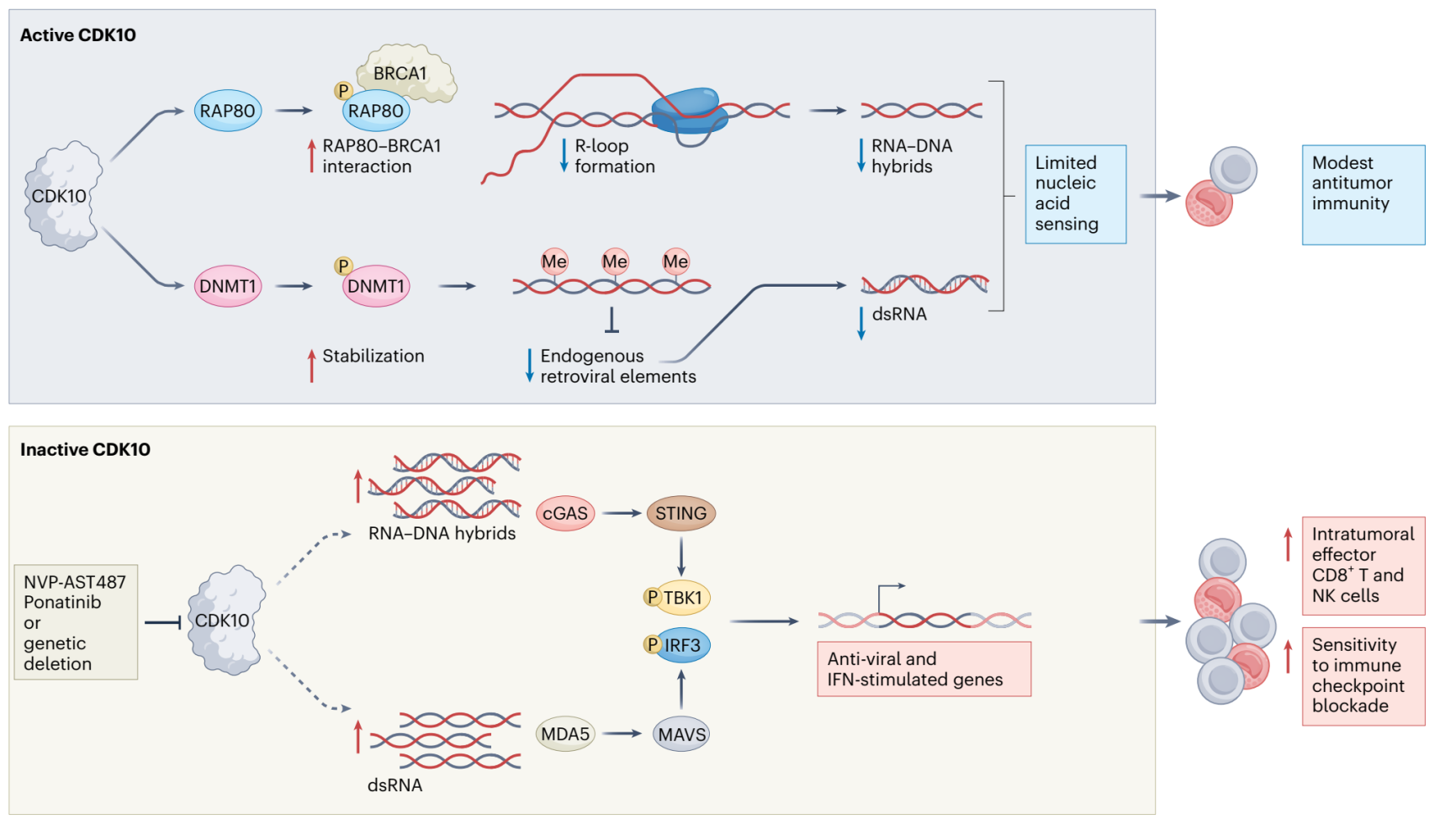
Nature Cancer 2026, doi.org/10.1038/s43018-025-01100-3
排版:高杨
审核:牛林,刘志博