当细胞内发生脂质过氧化时,细胞膜、线粒体膜、内质网膜等结构中的多不饱和脂肪酸(PUFA)会发生降解生成脂源性亲电小分子(lipid-derived electrophiles,简称LDEs )。这些小分子大多具有α, β-不饱和醛或酮的结构,可以与蛋白的亲核性残基Cys, His和 Lys发生Michael加成反应形成羰基化修饰,从而影响蛋白的结构和活性。到目前为止,羰基化修饰已被报道与神经退行性疾病、糖尿病、心血管疾病等多种病理条件密切相关,因此羰基化修饰蛋白和位点的鉴定对于理解相关疾病的发生具有重大意义。
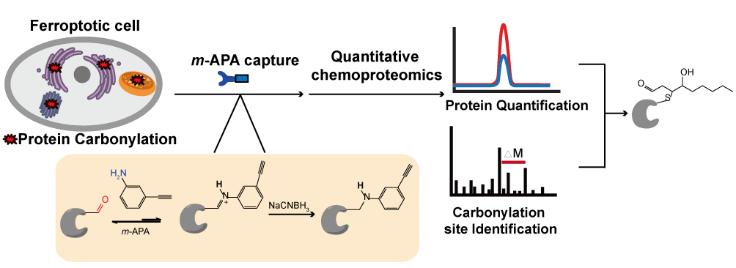
王初课题组的一个重要研究方向是发展化学蛋白质组方法对生理和病理状态下细胞内蛋白质的羰基化修饰进行选择性标记和质谱分析 (Curr Opin Chem Biol 2016,30, 37-45)。在2017年,课题组发展了生物正交的羟胺探针,以经典的LDE分子4-羟基壬烯醛(HNE)为模型,结合还原性二甲基化标记技术,实现了对外源的羰基化修饰蛋白和位点进行了直接的大规模捕获和鉴定 (Redox Biol 2017,12, 712-718)。然而鉴定病理条件下内源性羰基化的修饰蛋白及位点仍是该领域的重大挑战。为了解决这一难题,王初课题组首次将广泛应用于oxime ligation中的催化剂苯胺结构引入到活性分子探针中,首先以HNE为模型分子,建立和优化了蛋白羰基化修饰的定量化学蛋白质组方法,实现了对上千个羰基化修饰位点的修饰活性的定量分析。苯胺探针与此前大家常用的酰肼、羟胺类探针相比,肽段的加成物的化学性质十分稳定,可以避免质谱制样和上机过程中发生碎裂,因此具有更高的灵敏性,非常适合研究信号微弱的内源性羰基化修饰。
王初课题组选择了将苯胺探针应用于检测细胞“铁死亡”(ferroptosis)过程中蛋白羰基化修饰。铁死亡是在2012年最新被发现和定义的一种细胞死亡方式,它在细胞形态学、生化特征以及基因水平上都与细胞凋亡、坏死、自噬等传统的细胞死亡方式具有显著的差别。铁死亡有两个显著特征:死亡过程依赖铁元素和细胞内的活性氧物种(ROS)水平升高。目前常用的两种铁死亡诱导剂是RSL3和erastin,它们可以通过直接或间接的方式抑制 谷胱甘肽过氧化物酶(GPX4)的活性,从而抑制细胞清除脂质过氧化物的能力,导致ROS不断累积,引发细胞死亡。
王初课题组利用苯胺探针,并结合还原性二甲基化标记策略,鉴定出超过400个在铁死亡中发生羰基化修饰的蛋白靶标。功能性分析显示这些蛋白主要定位在内质网、高尔基体、线粒体等富含多不饱和脂肪酸的细胞器中,并且富集到肺癌、肾损伤和HIV等疾病中。作者们进一步利用可切割的富集标签,成功地在发生铁死亡的细胞中鉴定到20余个被不同亲电脂质分子进行内源羰基化修饰的位点,并对其中的一个线粒体通道蛋白上的修饰位点进行了生化实验功能验证。本工作这是首次对细胞铁死亡过程中的羰基化修饰靶标蛋白的组学的研究,同时也是第一例被报道的在活细胞内鉴定到内源羰基化修饰位点的化学蛋白质组学研究,这些数据成果为后续深入的研究细胞铁死亡和氧化应激诱导的退行性疾病机理奠定了坚实基础。
本工作近日以长文的形式在Journal of American Chemical Society杂志在线发表,题目为“Quantitative profiling of protein carbonylations in ferroptosis by an aniline-derived probe”,并被选为当周的ACS Editor’s choice作为重点推荐文章。王初特聘研究员为本文通讯作者,第一作者为王初课题组化学学院四年级博士研究生、校长奖学金获得者陈影同学,王初课题组博士后刘源,本科生蓝童等多位同学为本课题的完成提供了帮助,德国慕尼黑Helmholtz研究所的Marcus Conrad教授等也参与了本课题的合作。