2026年1月28日,北京大学化学与分子工程学院、北大-清华生命科学联合中心雷晓光团队联合中国科学院物理研究所姜道华团队等多家单位在《自然》(Nature)杂志发表题为“Structure and mechanism of the human bile acid transporter OSTα/β”的研究论文。该研究利用低温冷冻电镜技术( cryo-EM ),首次解析了人源胆汁酸转运蛋白 OSTα/β 的高分辨率结构,系统揭示了 OSTα/β 新颖的组装方式及转运机制。
研究发现,OSTα/β 由两个 OSTα 与两个 OSTβ 亚基组装形成独特的“2+2”异源四聚体。其中,α-β 和 α-α 亚基界面之间形成紧密的相互作用,增强了 OSTα/β 复合物的稳定性(图一a)。此外,研究发现了胆汁酸的结合口袋:该口袋呈现出一半嵌入 OSTα 而一半暴露于膜环境的独特形式,口袋中的正电残基与胆汁酸带负电基团相互吸引,促进胆汁酸的结合。综合结构分析、转运实验和分子动力学模拟,研究揭示了胆汁酸在转运过程中会经历一个 180 度的翻转,而转运过程中 OSTα/β 主体结构保持相对稳定状态。
基于这些结果,研究人员提出了 OSTα/β 不同于传统的SLC蛋白“交替访问”模型的新型转运机制:该蛋白的底物转运过程不需要发生大幅度的构象变化,而是通过一个半嵌入膜内的底物通道,促进胆汁酸从胞内到胞外或者从胞外到胞内的双向转运,而转运方向则依赖于胆汁酸跨细胞膜的浓度梯度(图一 b和c)。该研究回答了长期以来关于 OSTα/β 组装方式和转运机制的根本问题,为理解胆汁酸的跨膜运输提供了全新的结构框架,也为针对 OSTα/β 的靶向药物开发奠定了坚实的理论基础。
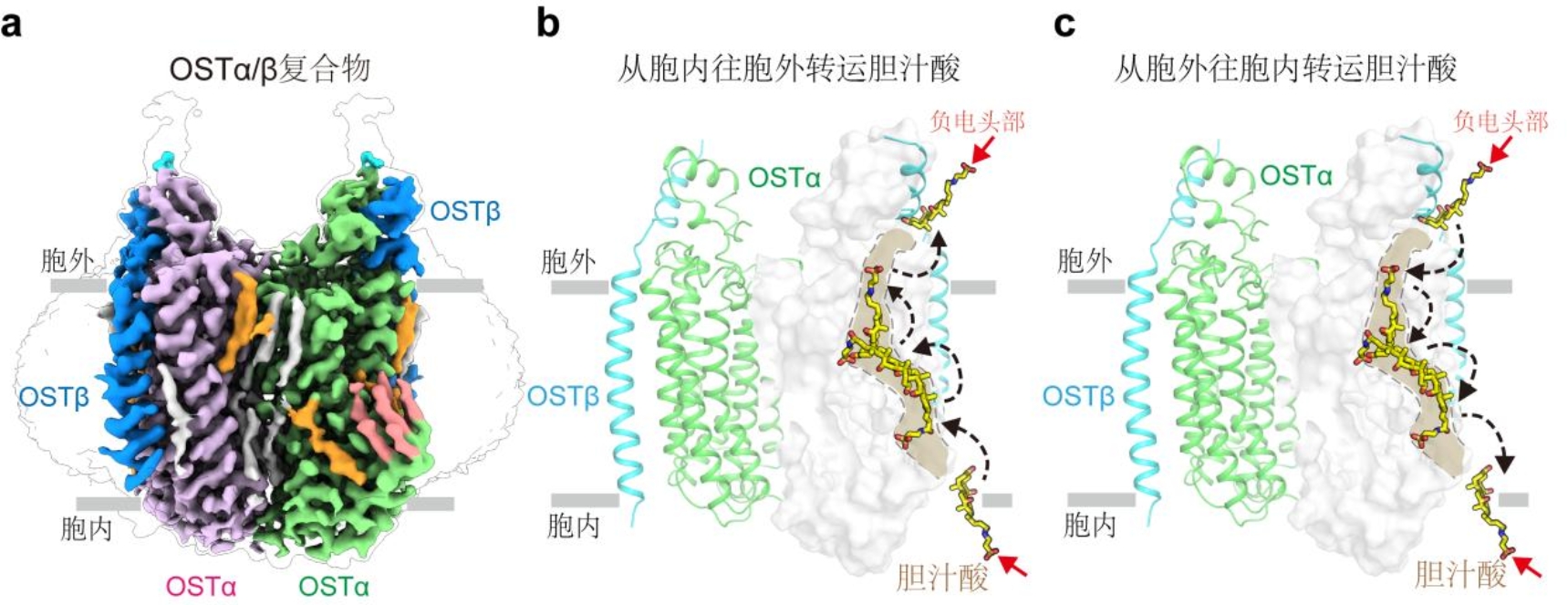
图一 OSTα/β的结构和转运机制
想象一下,你吃下去的油腻美食最终能被身体吸收利用,离不开体内一种神奇的“肥皂分子”——胆汁酸。它由肝脏生产,储存在胆囊里。每当你进食,胆汁酸就会进入肠道,像肥皂分解油渍一样,将食物中的脂肪乳化成微小颗粒,便于人体吸收。
令人惊叹的是,身体有一套高效的胆汁酸回收系统(肠肝循环):约 95% 的胆汁酸会被肠道重新吸收,经血液运回肝脏,循环利用。这套系统的高效运转,离不开几位精准配合的“物流专员”——转运蛋白(图一)。
其中,OSTα/β 这位专员尤为特殊。它不像其他常见的转运蛋白那样单兵作战,而是必须由 α 和 β 两个搭档共同组装才能上岗;它搬运胆汁酸时还不消耗任何能量( ATP ),完全依靠浓度差自然完成——这种“双人协作、节能环保”的工作模式,在整个转运蛋白家族中都十分罕见。
尽管 OSTα/β 功能至关重要(它的失常与消化不良、胆汁淤积等多种疾病相关),但长久以来,科学家一直看不清它的真面目:α 和 β 这两个搭档究竟如何组装?又是怎样完成胆汁酸转运的?
因此,破解 OSTα/β 的精细三维结构,就如同拿到了它工作的“设计图纸”。这不仅有助于理解胆汁酸循环的核心机制,更能为相关疾病的药物研发打开一扇全新的大门。
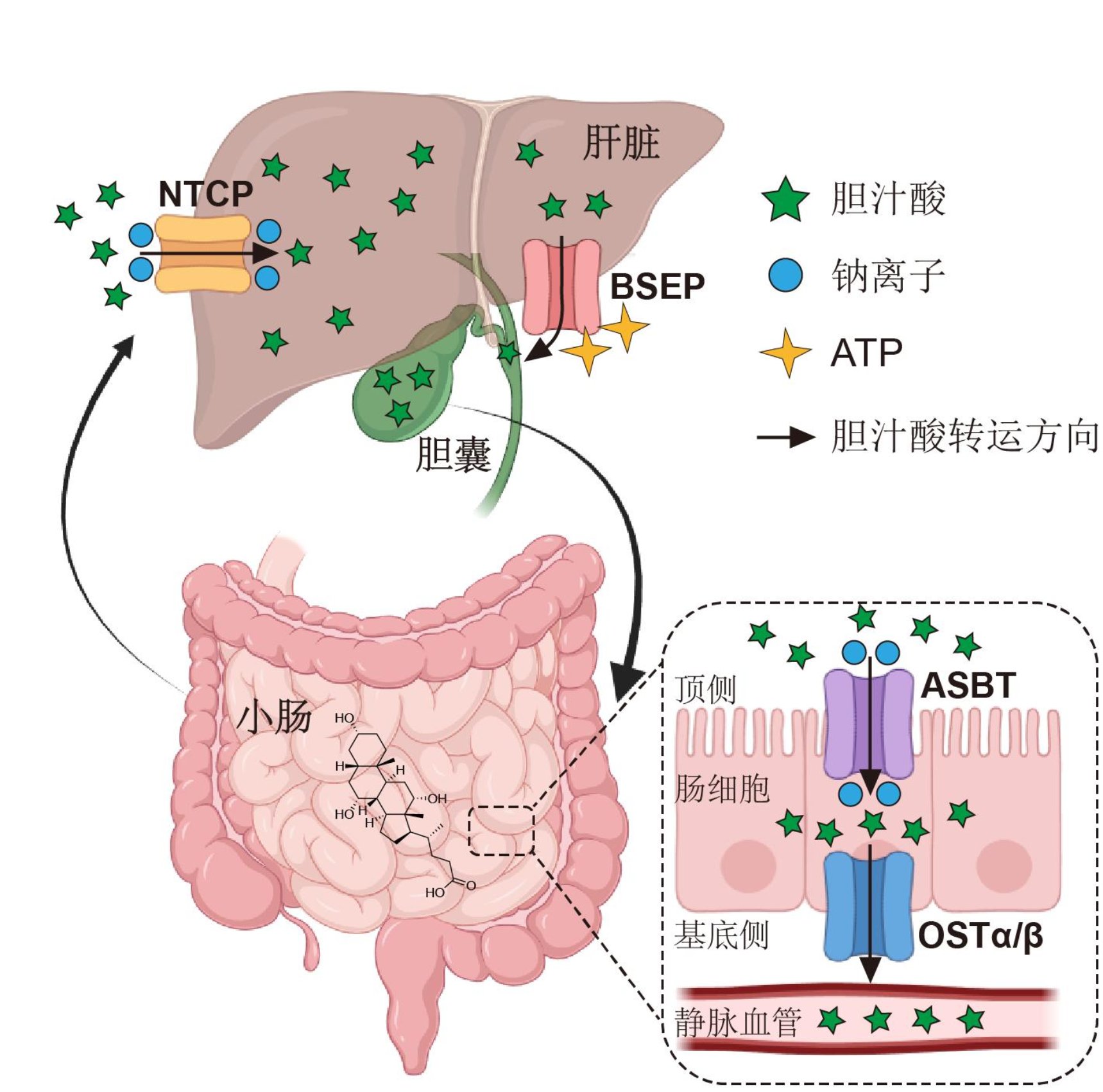
图二 人体肝肠循环中的胆汁酸转运
北大雷晓光团队长期开展胆汁酸的化学生物学、转化医学与新药开发研究。2017年,雷晓光团队的合作研究在《ACS中心科学》(ACS Central Science)杂志上发表了题为“Chemoproteomic Profiling of Bile Acid Interacting Proteins”的研究工作 (PMID: 36049085),通过利用化学蛋白质组学技术系统地揭示了胆酸结合蛋白,为进一步研究胆酸这一类重要内源性小分子在生理和病理条件下的生物功能提供了新思路。2024年,雷晓光团队与合作者在《细胞》( Cell )杂志上在线发表了题为“Structure-guided discovery of bile acid derivatives for treating liver diseases without causing itch”的开拓性研究成果( PMID: 39476841),深入阐明了胆汁淤积瘙痒的分子机制,首次解析了胆酸分子与“痒”受体蛋白的复合物结构,最终开发出对胆汁淤积等肝胆疾病具有良好治疗效果且克服了传统药物瘙痒副作用的候选药物分子,为相关疾病的精准治疗提供了新的思路。
姜道华,雷晓光及其团队成员范俊萍副研究员,东北农业大学姜巨全教授为该文的共同通讯作者。中科院物理研究所与南昌大学联合培养博士后王柯,范俊萍,中科院物理研究所博士后陈慧文,北京望石智慧科技有限公司黄博,北京大学现代农业研究院迟程教授为本文共同第一作者。华中科技大学与中科院物理研究所联合培养博士生颜芮,中科院物理研究所博士后武迪,北京望石智慧科技有限公司周峰,南昌大学张文华教授也为该研究作出了重要贡献。该研究得到了国家重点研发计划、国家自然科学基金委员会、北京分子科学国家研究中心、北大-清华生命科学联合中心、北京市“卓越青年科学家计划”、新基石研究员等项目和单位的资助。
原文链接:https://www.nature.com/articles/s41586-025-09934-8
排版:高杨
审核:牛林,刘志博