蛋白糖基化是一种重要的翻译后修饰,其修饰的蛋白底物范围和修饰位点由糖基转移酶与受体间的识别决定。酶催化的糖基化定点引入,是获得均一糖蛋白的重要方法,尤其在N-糖基化研究中已成为有效手段之一。细菌来源的糖基转移酶因其易于表达纯化等优良性质,常被改造为人工合成糖蛋白的工具酶。然而与N-糖基化不同,蛋白质O-糖基化通常缺乏严格、明确的识别序列,且O-连接糖基化修饰在原核生物与真核生物之间并不保守,细菌O-糖基转移酶在糖基供体和底物识别范围上与真核生物差距明显,导致通过细菌糖基转移酶向真核蛋白位点特异性引入O-糖基化修饰面临挑战。
2025年7月14日,北京大学化学与分子工程学院、北大-清华生命科学联合中心陈兴/戴鹏团队与北京大学生命科学学院、北大-清华生命科学联合中心肖俊宇团队合作,在 Nature Chemical Biology 杂志发表题为“Protein β-O-glucosylation by Legionella LtpM via short consensus sequons G-T/S and S-G”的研究论文,报道了嗜肺军团菌效应蛋白 LtpM 作为 β-O-葡萄糖基(β-O-Glc)转移酶的性质和应用。该工作鉴定了 LtpM 的修饰底物,阐明了其通过识别 G-T/S、S-G 序列向许多真核蛋白定点引入 β-O-Glc 修饰的机制。通过 LtpM 这一定点引入 O-糖基化修饰的有力工具,初步揭示了 O-Glc 替代 O-GlcNAc 修饰介导液-液相分离的潜力。

在开发 O-糖基转移酶的过程中,团队将注意力聚焦在了病原菌效应蛋白上,部分效应蛋白具有糖基转移酶活性,使用真核宿主细胞的糖供体并修真核蛋白底物。在前期发展的 α-O-Glc 糖基转移酶 SetA 基础上[1],进一步开发了高效、位点特异性引入 β-O-Glc 修饰的新工具。使用带有生物正交基团修饰的糖供体(尿苷二磷酸-6-叠氮-葡萄糖,UDP-6AzGlc),通过化学酶法策略结合串联质谱,鉴定了嗜肺军团菌效应蛋白 LtpM 在细胞裂解液中的修饰底物(图1);在853个底物蛋白上鉴定到1176个修饰位点,发现 LtpM 严格识别 G-T/S、S-G 序列。核磁共振表征证实 LtpM 催化形成的是 β-O-Glc修饰。通过X射线晶体结构研究、分子模拟与生化表征,团队探究了 LtpM 的催化机理和对蛋白底物的识别机制。LtpM 糖基供体结合口袋上方存在 F166、Q167、W228 和K225 四个氨基酸残基作为门控位点(gatekeepers),形成了狭窄的底物蛋白通道,从而严格限定所修饰的丝氨酸/苏氨酸相邻残基必须为甘氨酸这一侧链最小的氨基酸。
LtpM 独特的两氨基酸识别序列(G-T/S、S-G)使其成为一种有力的糖基化研究工具,在包括天然 Notch 蛋白在内的众多靶蛋白底物上实现了位点特异性 β-O-Glc 标记。对于不符合该识别序列的目标修饰位点,可通过插入或突变单个甘氨酸残基实现修饰,减少了引入长识别序列带来潜在蛋白结构干扰。基于对糖基供体底物修饰的容忍性,使用 UDP-6AzGlc 作为糖基供体,LtpM实现了位点特异性地向目标蛋白质引入生物正交基团并进一步偶联各种功能探针,为生物偶联提供了新方法。
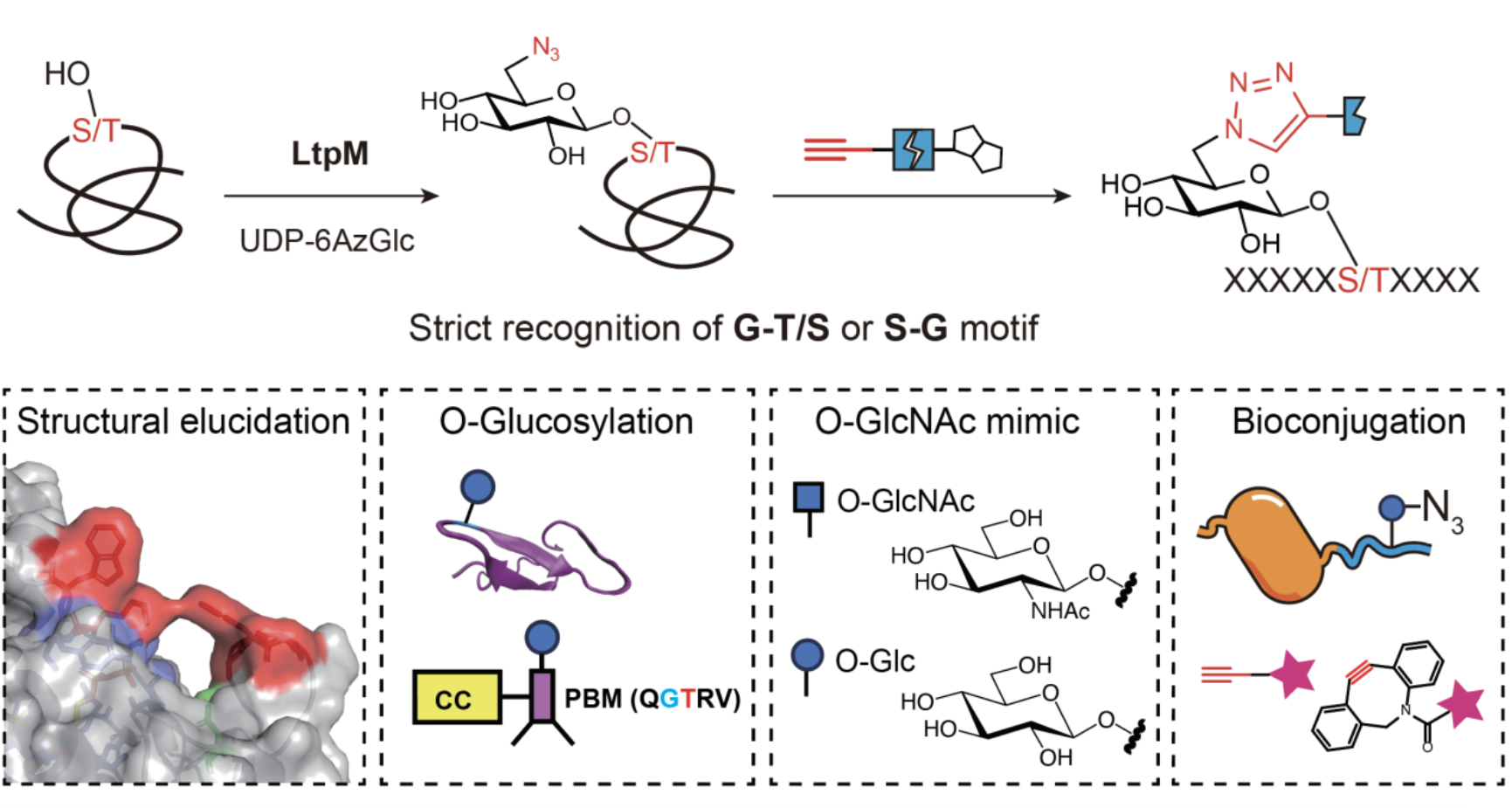
图1. LtpM严格识别 G-T/S、S-G 序列实现 β-O-Glc 修饰的定点引入。
考虑到 β-O-Glc 修饰与 O-连接的 β-N-乙酰氨基葡萄糖(β-O-GlcNAc)这一重要糖基化修饰的结构相似性,团队提出 O-Glc 有望作为不被 OGA 水解的 O-GlcNAc 功能替代物(functional surrogate)发挥作用这一科学假设,并使用 LtpM 定点引入 O-Glc 加以阐释验证。SynGAP 蛋白T1306位的 O-GlcNAc 修饰通过阻断其与 PSD-95 蛋白的相互作用,抑制两者液-液相分离过程[2]。通过 LtpM 高效地向 SynGAP T1306位点特异性引入 O-Glc 修饰和相分离表征,揭示了 O-Glc 替代 O-GlcNAc 介导液-液相分离的潜力。
综上所述,这项研究实现了对军团菌效应蛋白 LtpM 的底物鉴定、酶结构解析和催化识别机理研究,揭示了独特的两氨基酸识别序列。该工作为带有 β-O-Glc 修饰糖蛋白的精准合成和该修饰的功能研究提供了高效的标记新工具。
陈兴教授、戴鹏副研究员、肖俊宇教授为该论文的共同通讯作者,李威、高玲、崔世勇和魏田田为共同第一作者。该研究获科技部、国家自然科学基金、北京分子科学国家研究中心、中国化学会青年人才托举工程和“科学探索奖”等项目的支持。
原文链接:
https://www.nature.com/articles/s41589-025-01968-3
参考文献:
[1] Gao, L. et al. Legionella effector SetA as a general O-glucosyltransferase for eukaryotic proteins. Nat. Chem. Biol. 15, 213–216 (2019).
[2] Lv, P. et al. O-GlcNAcylation modulates liquid–liquid phase separation of SynGAP/PSD-95. Nat. Chem. 14, 831–840 (2022).
排版:高杨
审核:牛林,刘志博