过去数十年里,生物催化蓬勃发展,已经成为一种高效、实用和绿色可持续性的化学合成策略,并逐渐在合成化学中得到更多应用,与传统的金属和有机催化一起共同推动合成化学的发展。生物催化取得广泛应用的一个重要驱动力便是不断发现或发展具有新的催化能力的酶,从而扩大生物催化工具箱。借助光催化领域基于自由基中间体的激活转化模式,将其与酶催化结合的光酶催化,近年来成为开发新酶功能的前沿领域。
北京大学化学与分子工程学院,北大-清华生命科学联合研究中心雷晓光教授团队长期开展新型生物合成酶的挖掘,酶学机制,酶工程改造与生物催化研究。近期在相关领域中做出了多项开拓性研究成果(Nature 2025; Science 2024;Nat. Synth. 2024;Acc. Chem. Res. 2024;ACIE 2024; JACS Au 2024 ; ACIE 2023 ; ACIE 2022 ; Nat. Catal. 2021;Nat. Chem.,2020)。
近日,该团队借助协同催化和直接激发的两种光酶催化模式,分别在JACS和JACS Au上背靠背在线发表研究论文,集中报道了光酶协同催化的不对称氟烷基化/环化级联反应以及光酶催化的不对称氰烷基化反应(图1)。基于上述新型的光酶催化体系,成功实现了结构多样的有机分子的高效、精准合成。
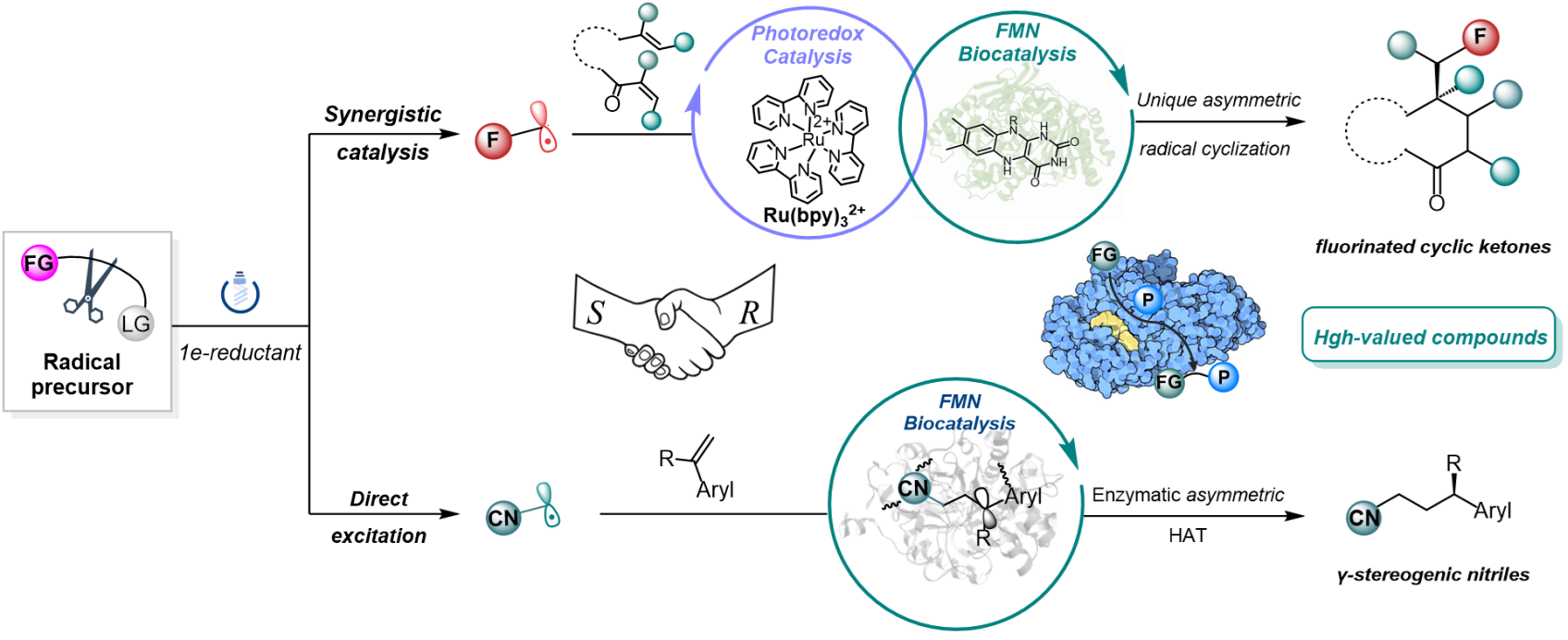
(图1)基于新型光酶催化的有机分子高效、精准合成
含氟分子由于其优异的物理化学性质,在制药、成像和材料等领域具有极其重要的价值。然而,由于氟原子的强电负性等性质,不对称氟化反应对于化学或生物催化而言一直是一项极其困难的挑战。此外,腈类化合物在材料科学、农化和制药工业中具有重要的应用价值,在有机合成中,氰基还是构建不同官能团的重要前体。鉴于含氟有机化合物和有机腈类化合物的重要性,目前科学界需要迫切的开发出简单、绿色的方法,用以高效和选择性合成系列氟化或氰基化产物。
传统的氟化或氰化方法往往需要过渡金属参与,并且利用毒性较强的氟代或氰代试剂作为氟源或氰源,不利于环境友好。另一方,不对称的官能团化反应往往面临反应收率低,选择性差,难以应用等问题。虽然前期已有一些酶催化的氟化和氟烷基化工作被报道。然而,增加这一领域现有方法的多样性,特别是直接引入三氟甲基等氟烷基策略的开发仍然具有相当大的意义,而生物催化的氰烷基反应也仍有待进一步发掘。
为进一步拓展生物催化的工具箱,雷晓光教授团队开发了一种独特的光酶协同催化的策略,该方法利用黄素依赖的“烯基”还原酶和钌光敏剂,以全氟碘代烷烃作为氟化试剂,烯基烯酮作为自由基受体,高效且高对映选择性地合成一系列氟代环酮类化合物(图2)。

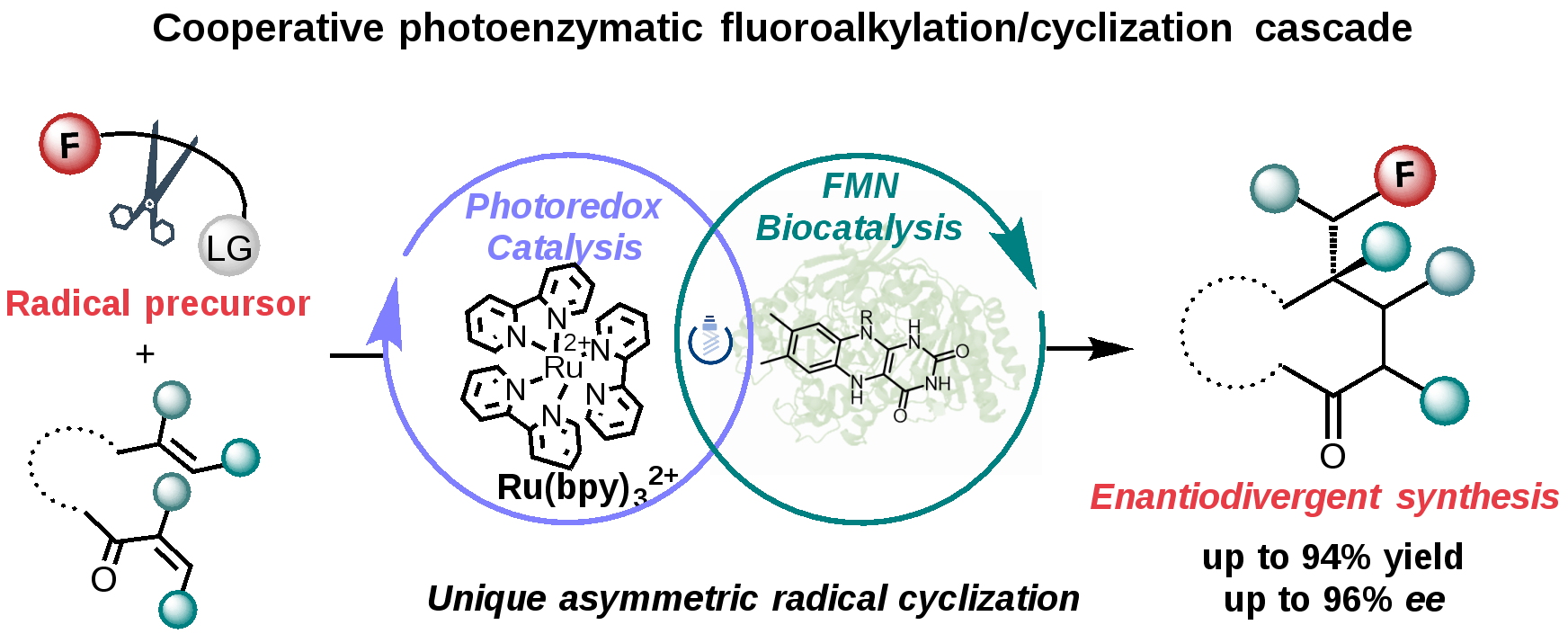
(图2)光酶协同催化的氟烷基化环化级联反应构建手性氟代环酮类化合物
此外,为进一步填补光酶催化的氰烷基化反应,立体选择性合成腈类化合物的空白。雷晓光教授团队开发了以绿色易得的碘乙腈为氰源,在光照及烯基还原酶催化下成功实现了一系列不同取代的烯基杂芳烃的不对称氰烷基化反应。其他杂芳环及苯乙烯等类型的底物也可以兼容于本反应,展现了本方法在一系列γ-手性腈类化合物的合成上的巨大价值与潜力(图3)。

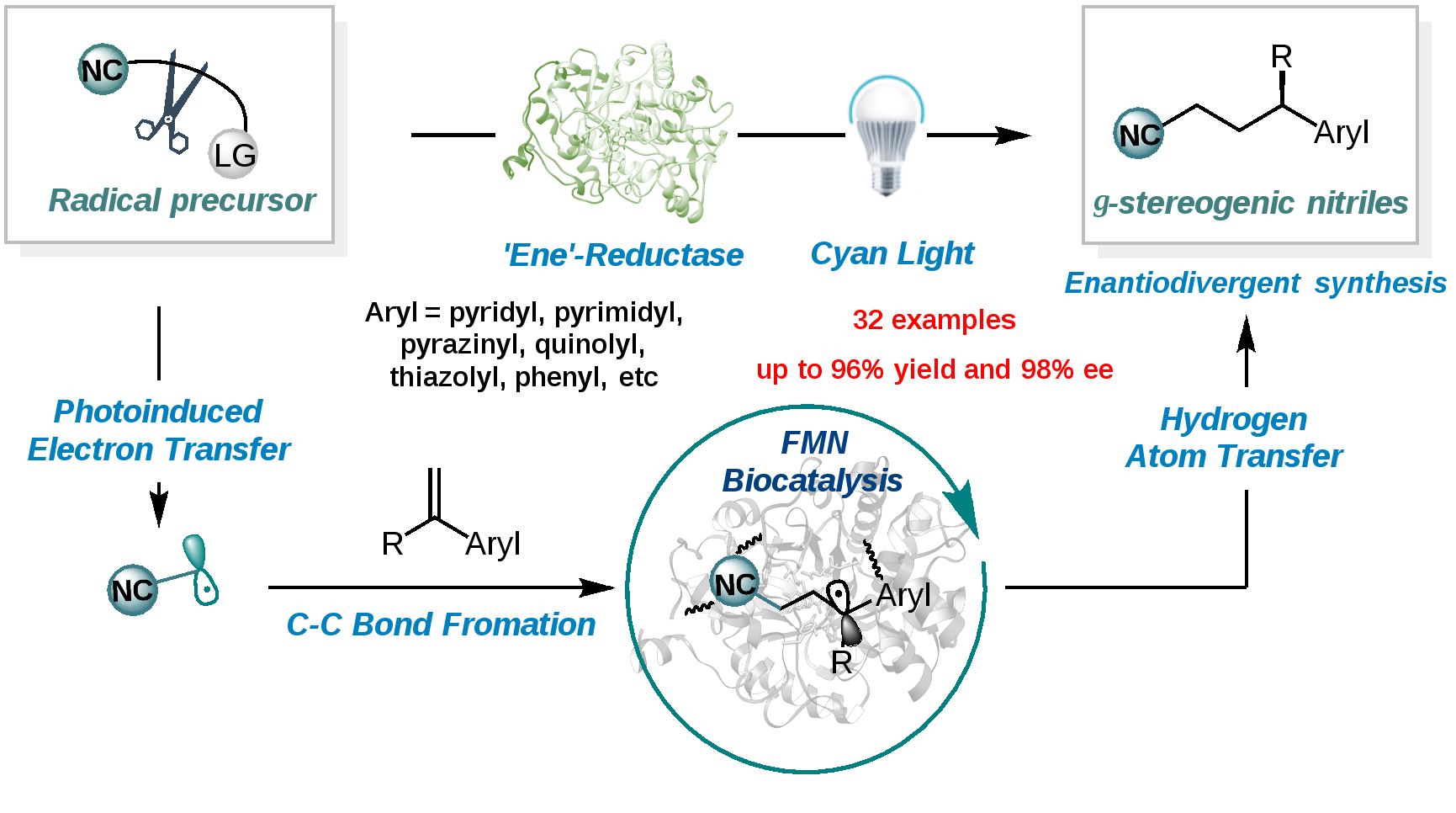
(图3)光酶催化的氰烷基化反应构建手性腈类化合物
借助共晶结构及定向进化,上述研究均成功获得了一对立体选择性互补的酶,实现了产物的对映发散性合成,一系列不同取代的底物均可以兼容于上述反应。且上述反应对自由基前体均表现出了较大地兼容性,不论是各种氟代基团还是含有胺基、酯基的自由基前体均可兼容于官能团化环化级联反应;不同的氰代自由基前体也可以顺利兼容氰烷基化反应。均能以高的立体选择性获得对应的产物,进一步增强了这一策略在功能分子合成上的应用潜力和价值。
通过等温滴定、光谱实验、自由基捕获和电子顺磁共振等实验,研究团队顺利解析了反应过程中涉及的中间体,同位素标记实验进一步确定了核黄素辅因子是产物中氢原子的主要来源。最后本研究通过分子动力学模拟阐明了酶与中间体之间不同的结合模式导致了不同立体选择性的原因,再次强调了酶在含氟及含氰化合物对映发散合成中的巨大潜力。为制药、材料等领域提供了含氟及含氰分子新的精准合成策略,符合当前绿色化学和可持续化学的发展趋势。
在光酶催化的氟烷化/环化课题中,北京大学化学与分子工程学院雷晓光课题组博士后吴东山为论文的第一作者,雷晓光课题组已毕业的王三山博士、博士生张浩文、柯瀚、孙泽英、谢舒涵、高一卉、博士后杨军等做出了重要贡献,北京大学化学与分子工程学院王炳武教授对电子顺磁共振相关实验给予了大力支持和指导;在光酶催化的氰烷基化课题中,雷晓光课题组博士后吴东山和博士生孙泽英为论文的共同第一作者,雷晓光课题组已毕业的王三山博士、博士后杨军、本科生贺静远等做出了重要贡献。雷晓光教授为两篇文章的唯一通讯作者。该工作得到了国家重点研发计划、国家自然科学基金委员会、北京分子科学国家研究中心、北大-清华生命科学联合中心、新基石基金会等项目或单位的资助。雷晓光团队所开展的生物催化与化学酶法合成研究工作也得到了瑞士诺华制药公司的长期资助。
原文链接:
排版:高杨
审核:李玲,刘志博