细胞核是遗传物质的主要存储区和加工、调控中心。基因组DNA受到损伤后,细胞核内随即开启一系列由多种蛋白参与的协同有序的复杂修复过程。但由于核膜的屏障和细胞内复杂的组成环境,对活细胞的细胞核中内源性核酸修复蛋白的原位动态观测是一个极具挑战性的难题。
脱嘌呤/脱嘧啶核酸内切酶1(APE1)是一种重要的核酸修复蛋白,在碱基切除修复(BER)途径中发挥核心作用,同时还是许多转录因子的氧化还原激活剂,并参与RNA的加工等。2024年3月30日,北京大学化学与分子工程学院赵美萍课题组在《核酸研究》(Nucleic Acids Research)在线发表了题为“Live-cell imaging of human apurinic/apyrimidinic endonuclease 1 in the nucleus and nucleolus using a chaperone@DNA probe”的研究论文。该研究报道了一种全新的由蛋白分子伴侣保驾护航的DNA荧光探针,在确保对APE1具有特异性响应的同时,实现了探针的细胞核靶向,首次对活细胞核内不同区域的APE1进行了动态可视化观测。
研究团队在前期的研究中发现,将生物素标记的含缺碱基位点的DNA(AP-DNA)通过亲和素(AVD)组装在二氧化硅包覆的磁性纳米颗粒表面时,该AP-DNA可以自然抵抗多种核酸酶的酶切,但却可以被APE1有效地识别和定点切割(Nucleic Acids Res. 2017, 45, e45; J. Am. Chem. Soc. 2018, 140, 16925)。随后的研究表明,生物素标记不仅将AP-DNA探针锚定在亲和素分子上,同时还显著提高了AVD对APE1结合的亲和力。基于新发现的APE1-AVD-DNA三元体系两两互作的协同效应,研究团队创建了一种全新的蛋白分子伴侣策略来实现对DNA探针的保护(图1)。
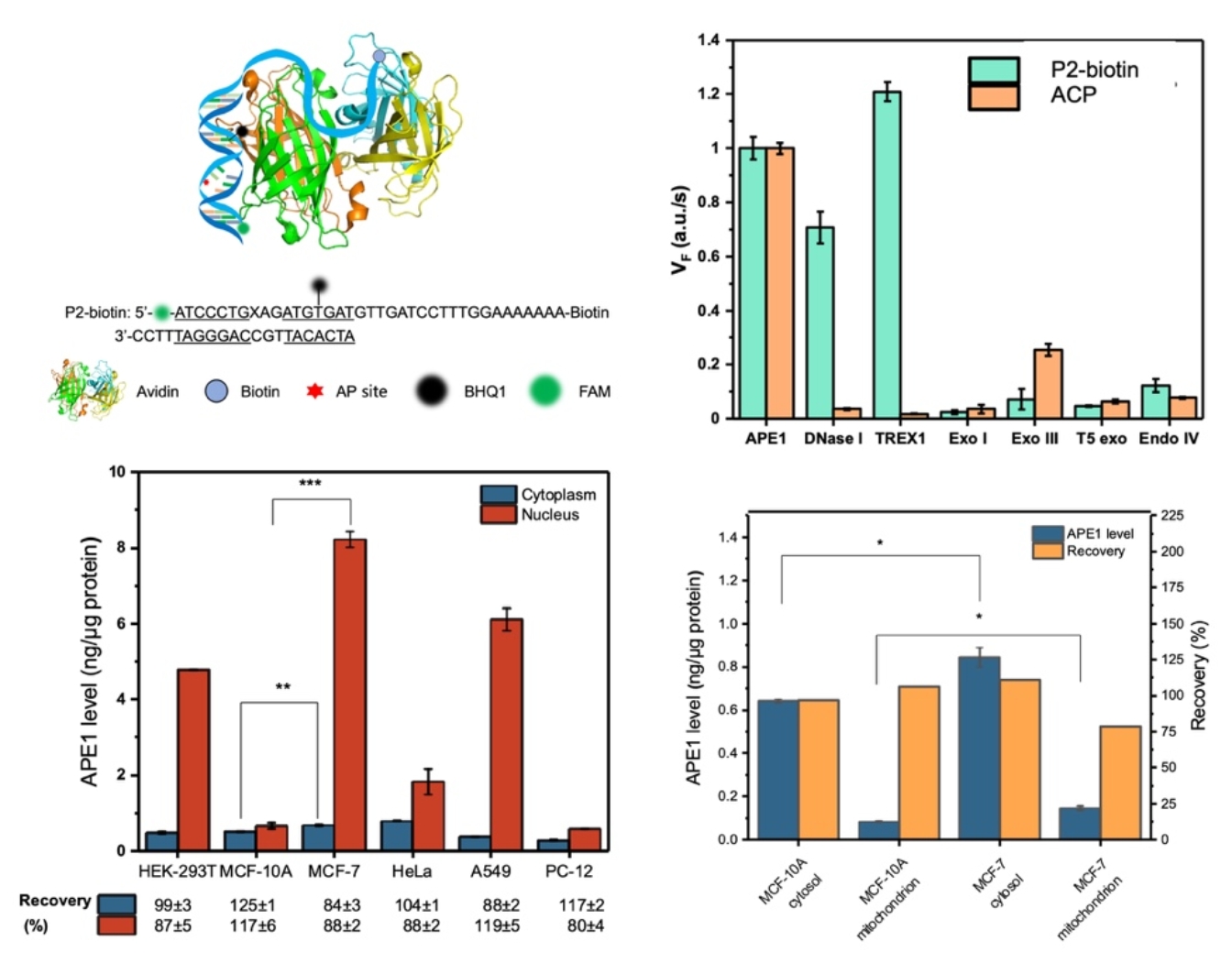
图1. ACP荧光探针的构建、选择性和对不同类型细胞的细胞器中APE1的定量测定。
研究团队利用特异性抑制剂、免疫沉淀法和基因敲除细胞系等确证了ACP探针的特异性,对不同类型细胞的细胞质、细胞核、线粒体和外泌体等提取蛋白中的APE1含量进行了定量比较。数据反映出不同细胞间细胞核内APE1的含量差异巨大,而细胞质中的APE1含量差别较小。
作者进一步用苯硼酸衍生物共价修饰AVD,制得的探针(PB-ACP)通过输入蛋白α/β途径靶向细胞核的能力在多种细胞系中都得到了证实(图2)。研究揭示出APE1在基因表达活跃和DNA损伤程度较高的常染色质区域活性较高,在核仁区有明显的分布,而在异染色质区分布相对较少。
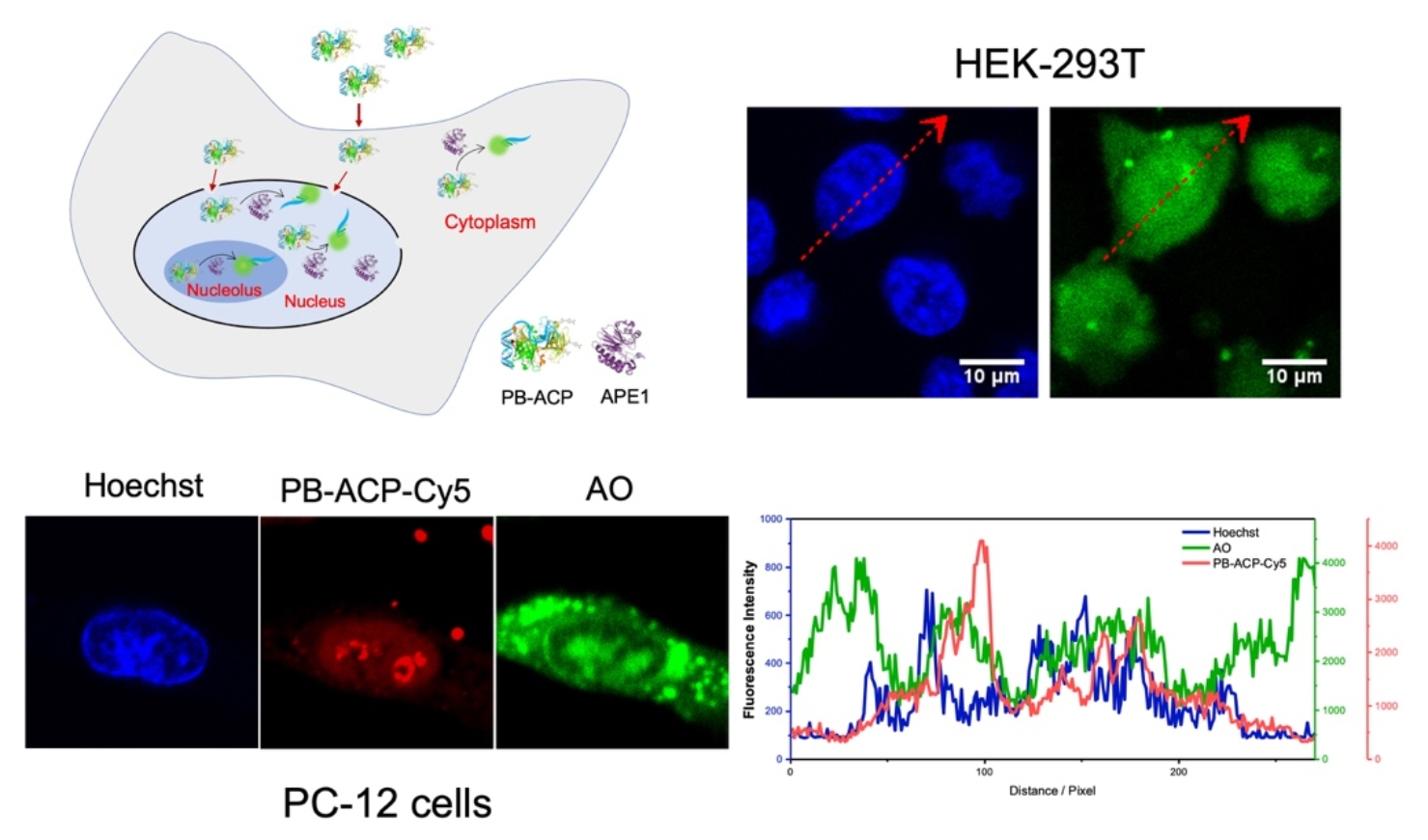
图2. 由苯硼酸修饰亲和素构建的分子伴侣@DNA荧光探针(PB-ACP)及其在不同类型活细胞的细胞核内对内源APE1的荧光响应。
APE1在细胞内不同的区域中发挥着不同的作用,其在细胞核中的分布和动态迁移与其执行多种功能密切相关。作者进一步展示了细胞在受到不同类型刺激时APE1活性和分布的变化(图3)。
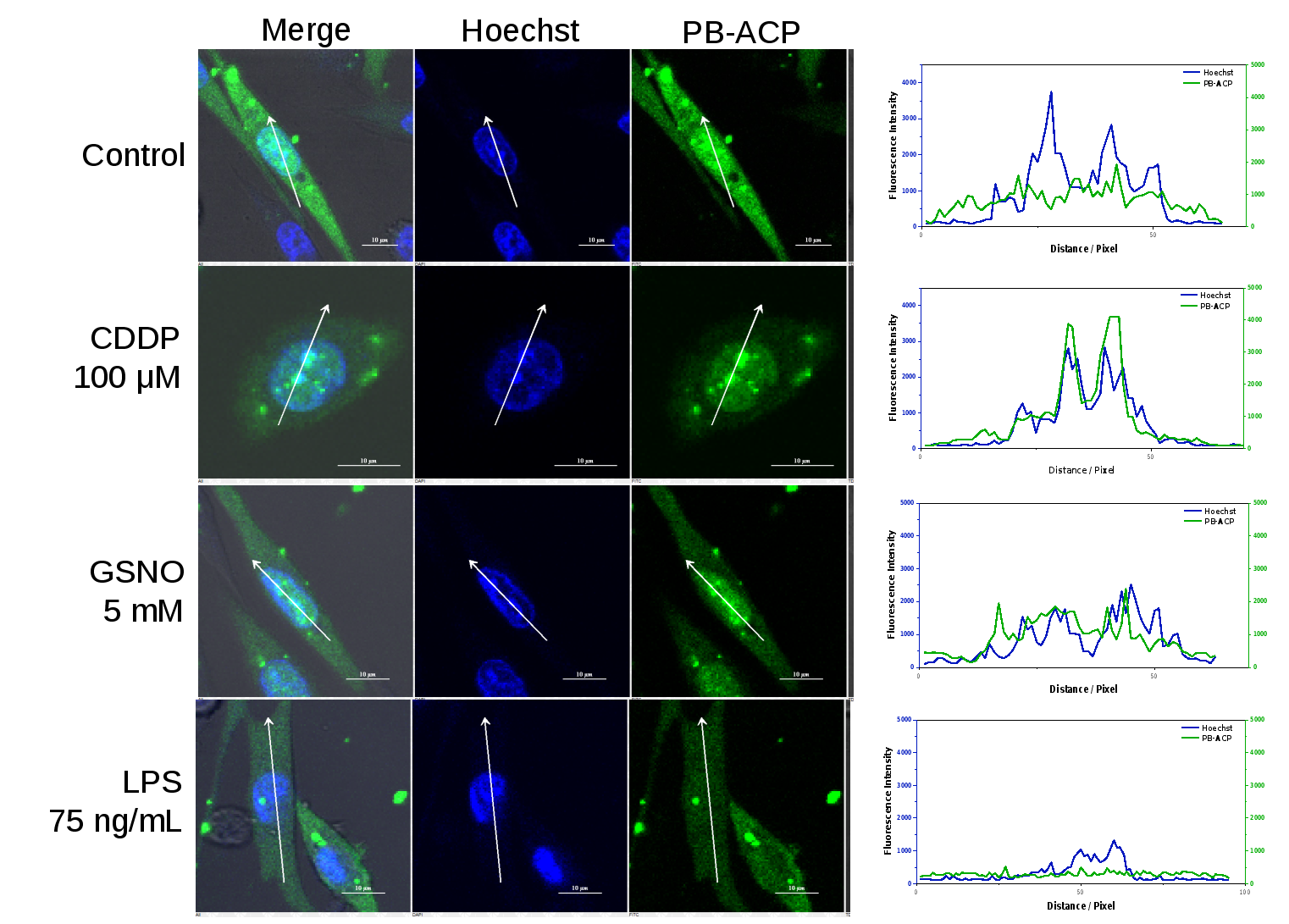
图3. 在不同条件刺激下活细胞内APE1活性和分布的变化
该研究为在活细胞水平全面理解核酸损伤修复的动态过程和分子机理提供了新颖、高效的分子工具,对深入研究细胞衰老机制、肿瘤等疾病的发生发展和针对性治疗等有积极的推动作用。研究提出的分子伴侣协助核酸探针策略也为未来进一步开发更加智能化的核酸探针开拓了一种全新的模式。
北京大学化学与分子工程学院已毕业博士生曹翔剑、在读博士生郑菁卉和张芮兰为该论文的共同第一作者,北京大学化学与分子工程学院赵美萍教授为通讯作者。北京大学分析测试中心(PKUAIC)的关妍老师和周文老师分别对荧光成像和质谱分析提供了很大帮助。该研究得到国家自然科学基金委和北京分子科学国家研究中心的资助与支持。
原文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkae202/7637892
排版:高杨
审核:李玲,彭海琳