细胞作为生物体生命活动的基本单元,为了不被干扰地同时进行多种复杂的生化反应,演化出许多膜包被的细胞器——如细胞核、内质网、高尔基体、线粒体等——对异质性的生化过程进行区块化的分隔,保证不同的反应在特定的区域内高效、有序地完成。除了膜包被的细胞器外,还存在一类无膜包被或者半膜包被的可以富集生物大分子的结构,例如核仁、应激颗粒(Stress granule),以及神经元中的突触后致密区(postsynaptic density, PSD)等1–3。近年来,这些结构的形成原理和功能在科学界引起了极大的关注,人们发现这类结构一般是通过蛋白-蛋白或蛋白-RNA相互作用形成液–液相分离(Liquid-liquid phase separation, LLPS)产生的。LLPS主要以不同蛋白结构域、蛋白内在无序区(intrinsic disordered region)以及蛋白-RNA间形成的多价相互作用为驱动力而发生2。无膜或半膜细胞器在细胞中发挥重要的功能,相比于传统的膜包被的细胞器,它们可以更高效地与外界环境发生物质交换,同时保障结构内的物质在细胞内处于相对独立的空间,其组成与浓度可以被精确调控。目前,针对LLPS在生理及病理状态下的功能研究已取得诸多突破性成果,LLPS已被证明在基因表达调控4、细胞对外在环境的压力响应5、先天免疫应答6、神经退行性疾病的发生7等方面均发挥重要作用。基于这些成果,对液–液相分离过程的精准时空调控及其分子机制的研究也方兴未艾。
蛋白的翻译后修饰(post-translational modifications, PTMs)可以通过改变氨基酸残基间的相互作用强度实现对液-液相分离体系的动态调控8。例如,精氨酸甲基化修饰通过减弱其与芳香氨基酸间的相互作用抑制Ddx4、hnRNPA2、FUS和FMRP等蛋白形成LLPS9–13;磷酸化修饰可以在不同的相分离体系起到截然相反的调控作用,如Tau7和FMRP14蛋白的磷酸化修饰促进其发生LLPS,而FUS和TDP-43的LLPS过程受磷酸化修饰抑制15,16。
尽管多种翻译后修饰已被阐明可以参与LLPS的调控,糖基化修饰——一种广泛存在于高等生物细胞中的翻译后修饰——对LLPS的调控作用却始终未被系统研究和阐释。O-GlcNAc修饰是存在于胞内蛋白丝氨酸和苏氨酸残基上的糖基化修饰,在哺乳动物大脑中广泛分布,其修饰酶OGT在兴奋性神经元PSD中大量富集17,18。北京大学化学与分子工程学院、北大-清华生命科学联合中心陈兴课题组一直致力于解析糖基化修饰在不同器官与组织中的分布和生物学功能。他们发现,PSD的重要组成蛋白SynGAP具有多个O-GlcNAc修饰位点。此前,香港科技大学(现南方科技大学)的张明杰课题组发现,SynGAP与PSD中的脚手架蛋白PSD-95所形成的复合物可发生液-液相分离,且该LLPS过程对于PSD的形成和功能具有重要意义19,20。基于此,陈兴课题组与北京大学药学院董甦伟课题组、张明杰课题组等合作,利用化学半合成策略构建了特定位点具有O-GlcNAc修饰的SynGAP蛋白,阐明了O-GlcNAc修饰对SynGAP/PSD95液–液相分离过程的调控和分子机制,相关成果以“O-GlcNAcylation modulates liquid–liquid phase separation of SynGAP/PSD-95”为题于2022年5月30日发表在Nature Chemistry杂志。

在所鉴定到的众多O-GlcNAc修饰位点中,他们选定了位于SynGAP蛋白CC-PBM结构域1159位丝氨酸(S1159)与1306位苏氨酸(T1306)两个位点进行深入研究,因为CC-PBM结构域通过与PSD-95蛋白PSG结构域的相互作用形成LLPS(图1a)。利用表达蛋白连接(expressed protein ligation, EPL)策略,他们合成了S1159与T1306位点特异O-GlcNAc修饰的SynGAP CC-PBM蛋白(SynGAP-S1159OG & SynGAP-T1306OG,图1b)。接着,通过液滴成像实验与沉淀离心实验,证明了SynGAP-T1306OG可以完全抑制LLPS形成(图1c)。结合同源结构模拟与体积排阻-静态光散射分析,他们提出SynGAP蛋白T1306位点的O-GlcNAc修饰通过阻碍T1306与PSD-95蛋白369位组氨酸(H369)间形成氢键,破坏蛋白相互作用进而阻碍LLPS形成,并在细胞内验证了该机理(图1d-e)。

图1 SynGAP蛋白O-GlcNAc位点鉴定,蛋白合成与抑制LLPS机理
O-GlcNAc修饰通常是亚化学计量,即修饰率不足100%。那么,亚化学计量的O-GlcNAc修饰能否有效地调控LLPS便是一个重要的问题。他们通过调整合成蛋白中O-GlcNAc修饰比例,模拟不同修饰率对LLPS的影响,结果显示不同修饰率(10% ~ 100%)均可以对LLPS产生不同程度的抑制。同时,与通过降低蛋白浓度抑制LLPS的方式相比,等比例的O-GlcNAc修饰对LLPS具有更明显的抑制效果,即O-GlcNAc对于LLPS的抑制呈现出显性负调控(dominant-negative effect)的特征(图2a-b)。此外,O-GlcNAc修饰对LLPS的抑制是动态可逆的,通过加入O-GlcNAc转移酶OGT或去修饰酶OGA可以动态地调节O-GlcNAc水平与LLPS阈值(图2c)。
陈兴课题组长期致力于糖化学和糖生物学研究,神经系统中的蛋白质糖基鉴定与功能研究是目前的重点方向之一。本工作利用化学半合成策略与多种技术手段,详细阐明了特定位点O-GlcNAc修饰对SynGAP/PSD-95液–液相分离的调控作用,揭示了O-GlcNAc修饰在该体系中显性负调控的作用方式和抑制LLPS发生的分子机制,证明了OGT/OGA对该过程的动态调控。该发现为诠释O-GlcNAc修饰在调控神经系统发育与突触可塑性等过程中的重要功能提供一个新的机制。同时,O-GlcNAc修饰可能作为一种普适性的调控机制,调控多种液–液相分离过程。
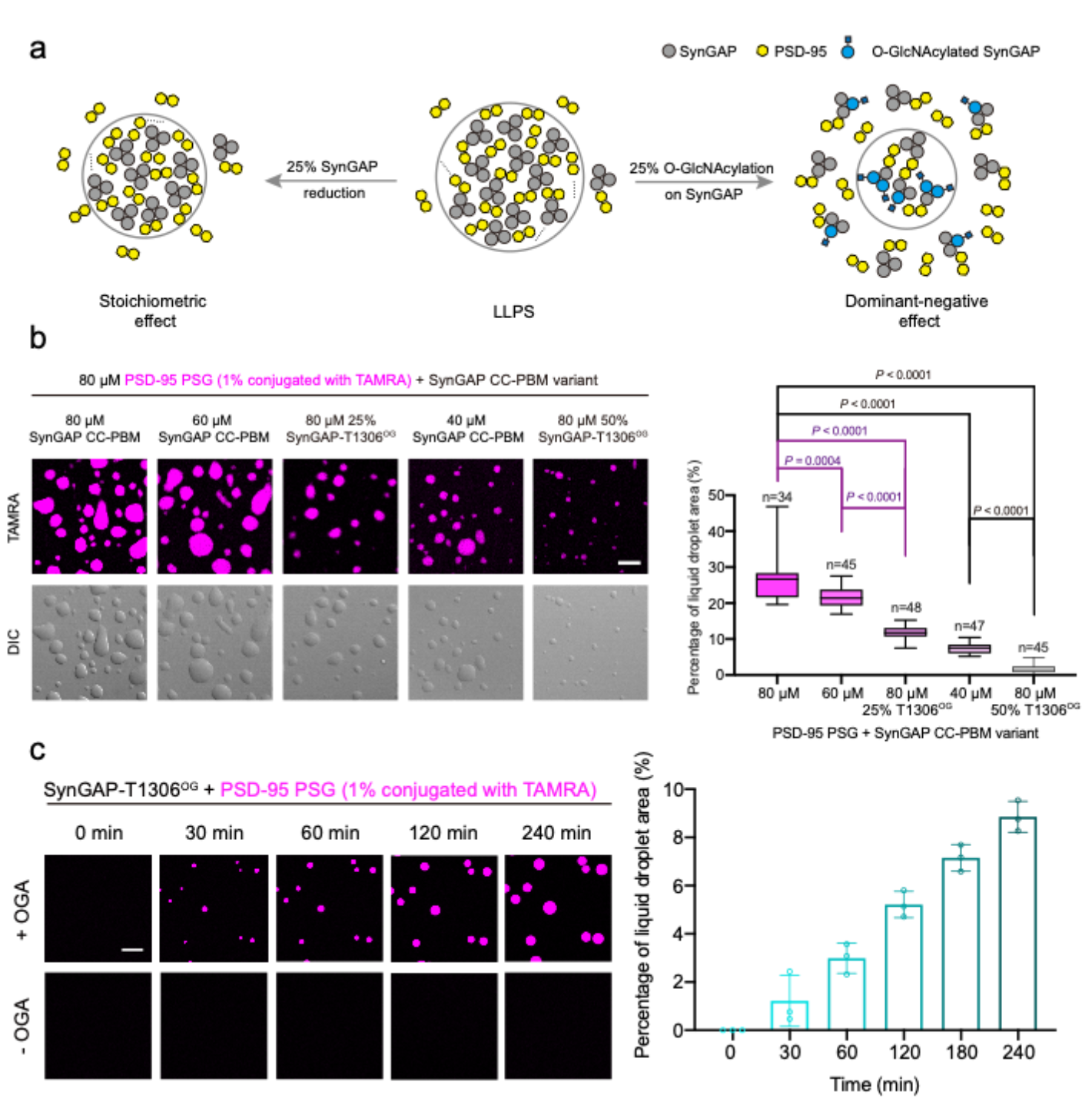
图2 O-GlcNAc修饰对LLPS的显性负调控与OGA动态调控
北京大学化学与分子工程学院、北大清华生命科学联合中心的陈兴教授和北京大学药学院、天然药物及仿生药物国家重点实验室董甦伟教授为本论文的共同通讯作者,生命科学联合中心已毕业博士生吕品欧、杜逸飞和北京大学药学院已毕业博士生贺长栋为论文的共同第一作者。南方科技大学生命科学学院张明杰课题组、北京大学生命科学学院李沉简教授和化学与分子工程学院邹鹏课题组参与了该研究工作。该研究工作得到了国家自然科学基金委、科技部、北大-清华生命科学联合中心和北京分子科学国家研究中心的资助。
原文连接:https://doi.org/10.1038/s41557-022-00946-9
参考文献:
1. Shin, Y. & Brangwynne, C. P. Liquid phase condensation in cell physiology and disease. Science 357, eaaf4382 (2017).
2. Banani, S. F., Lee, H. O., Hyman, A. A. & Rosen, M. K. Biomolecular condensates: organizers of cellular biochemistry. Nat. Rev. Mol. Cell Biol. 18, 285–298 (2017).
3. Chen, X., Wu, X., Wu, H. & Zhang, M. Phase separation at the synapse. Nat. Neurosci. 23, 301–310 (2020).
4. Sabari, B. R. et al. Coactivator condensation at super-enhancers links phase separation and gene control. Science 361, eaar3958-17 (2018).
5. Molliex, A. et al. Phase Separation by Low Complexity Domains Promotes Stress Granule Assembly and Drives Pathological Fibrillization. Cell 163, 123–133 (2015).
6. Du, M. & Chen, Z. J. DNA-induced liquid phase condensation of cGAS activates innate immune signaling. Science 361, 704–709 (2018).
7. Ambadipudi, S., Biernat, J., Riedel, D., Mandelkow, E. & Zweckstetter, M. Liquid–liquid phase separation of the microtubule-binding repeats of the Alzheimer-related protein Tau. Nat. Commun. 8, 275 (2017).
8. Hofweber, M. & Dormann, D. Friend or foe-Post-translational modifications as regulators of phase separation and RNP granule dynamics. J. Biol. Chem. 294, 7137–7150 (2019).
9. Nott, T. J. et al. Phase Transition of a Disordered Nuage Protein Generates Environmentally Responsive Membraneless Organelles. Mol. Cell 57, 936–947 (2015).
10. Qamar, S. et al. FUS Phase Separation Is Modulated by a Molecular Chaperone and Methylation of Arginine Cation-π Interactions. Cell 173, 720-734.e15 (2018).
11. Hofweber, M. et al. Phase Separation of FUS Is Suppressed by Its Nuclear Import Receptor and Arginine Methylation. Cell 173, 706-719.e13 (2018).
12. Ryan, V. H. et al. Mechanistic View of hnRNPA2 Low-Complexity Domain Structure, Interactions, and Phase Separation Altered by Mutation and Arginine Methylation. Mol. Cell 69, 465-479.e7 (2018).
13. Tsang, B. et al. Phosphoregulated FMRP phase separation models activity-dependent translation through bidirectional control of mRNA granule formation. Proc. Natl. Acad. Sci. U.S.A. 116, 4218–4227 (2019).
14. Kim, T. H. et al. Phospho-dependent phase separation of FMRP and CAPRIN1 recapitulates regulation of translation and deadenylation. Science 365, 825–829 (2019).
15. Murray, D. T. et al. Structure of FUS Protein Fibrils and Its Relevance to Self-Assembly and Phase Separation of Low-Complexity Domains. Cell 171, 615-627.e16 (2017).
16. Wang, A. et al. A single N‐terminal phosphomimic disrupts TDP‐43 polymerization, phase separation, and RNA splicing. Embo J 37, e97452 (2018).
17. Lagerlof, O. & Hart, G. W. O-GlcNAcylation of Neuronal Proteins: Roles in Neuronal Functions and in Neurodegeneration. in Glycobiology of the Nervous System vol. 9 343–366 (Glycobiology of the Nervous System, 2014).
18. Lagerlof, O., Hart, G. W. & Huganir, R. L. O-GlcNAc transferase regulates excitatory synapse maturity. Proc. Natl. Acad. Sci. U.S.A. 114, 1684–1689 (2017).
19. Zeng, M. et al. Phase Transition in Postsynaptic Densities Underlies Formation of Synaptic Complexes and Synaptic Plasticity. Cell 166, 1163-1175.e12 (2016).
20. Zeng, M. et al. Reconstituted Postsynaptic Density as a Molecular Platform for Understanding Synapse Formation and Plasticity. Cell 174, 1172-1187.e16 (2018).