约80%的化学药物是手性药物,其不同对映体在药效、药理、代谢等方面差异显著,因此,获得高光学纯度的单一对映体是确保药物安全性和有效性的关键。近日,北京大学化学与分子工程学院宛新华/张洁团队在手性药物的结晶分离方面取得重要进展,他们设计了一种新颖的磁性纳米拆分剂,实现了脑血管药物尼莫地平的高效拆分。此项研究以“Magnetic Sorting of Chiral Pharmaceuticals Using Fe3O4-Cellulose Acetate Phthalate Nanosplitters”为题发表在《Journal of the American Chemical Society》上(J. Am. Chem. Soc. 2025, 147, 37265-37271)。化学与分子工程学院的在读博士刘应泽为论文第一作者,宛新华教授和在站博士后陈艺夫博士为共同通讯作者。
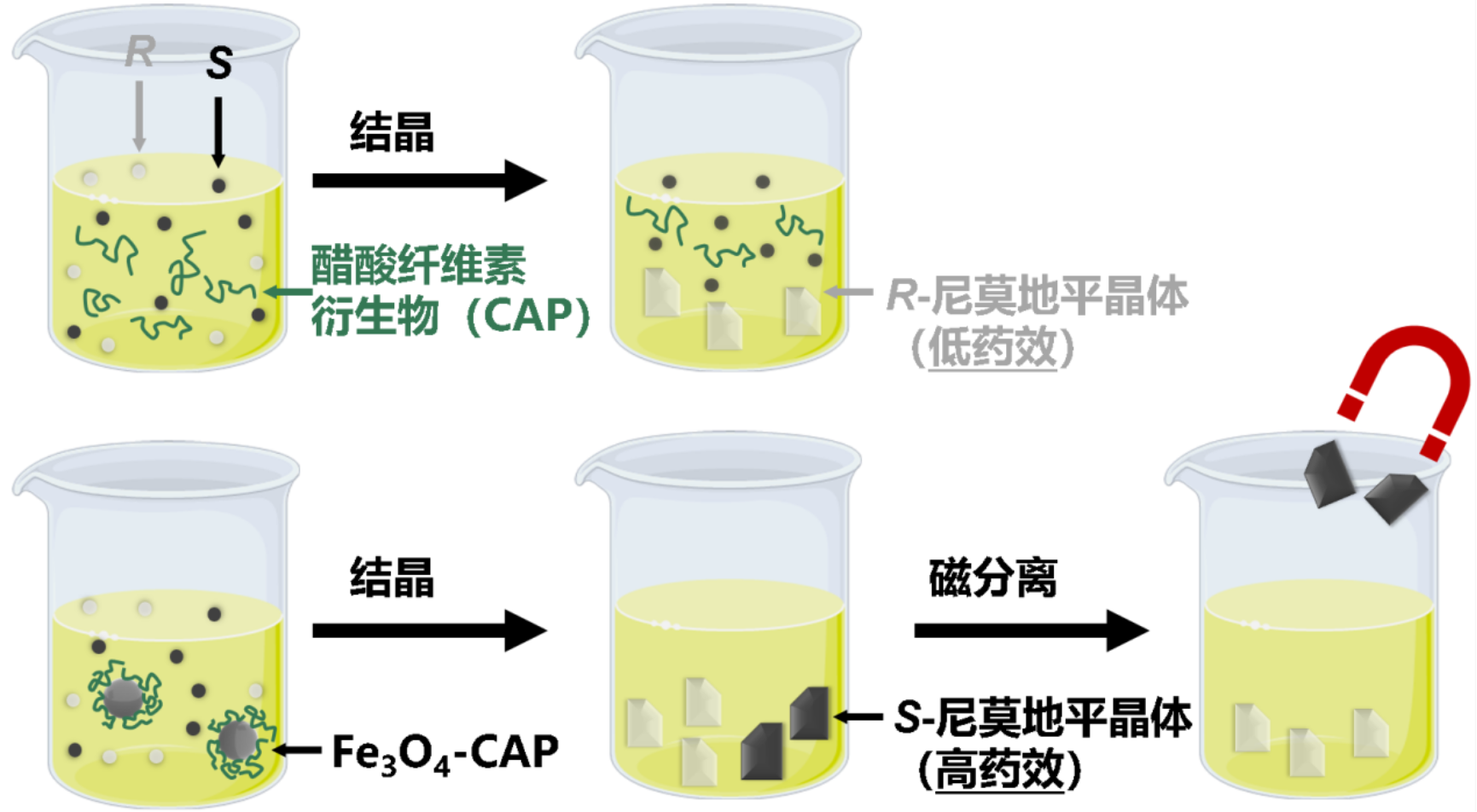
图 1 对外消旋尼莫地平的结晶拆分与磁分离。
根据“反转规则”,在逆向结晶过程中所得晶体的手性与所使用抑制剂的手性相反。对于小分子或合成高分子而言,只需合成具有相反手性的抑制剂,就能获得相反手性的对映体晶体。然而,天然高分子的手性由其生物合成途径决定,这从根本上限制了其通用性,因为几乎无法通过化学合成手段反转其固有手性以期获得另外一种对映异构体晶体。为此,北京大学化学与分子工程学院的宛新华/张洁团队设计了一种磁性纳米拆分剂,并将其用于脑血管药物尼莫地平的结晶拆分中。尼莫地平S-对映体的活性是R-对映体的5倍。通过将醋酸纤维素衍生物接枝到Fe₃O₄纳米粒子表面,其高分子壳层能够选择性富集原本被抑制的S-尼莫地平分子团簇,使其以磁性晶体的形式结晶,最终获得可观数量的无磁性R-晶体和有磁性S-晶体,再通过外加磁场将二者高效分离。而仅使用醋酸纤维素衍生物只能在结晶中得到活性低的R-晶体。进一步研究表明,聚合物的链长和Fe3O4纳米粒子的大小显著影响拆分效果。分子量大于20 kDa,且Fe3O4颗粒的尺寸在5-14 nm之间,拆分效果最优,S-和R-对映体的光学纯度分别为82ee%和92ee%,总产率为40%。此项研究突破了天然高分子在手性分离中的固有局限,研究中构建的磁性纳米拆分剂平台可拓展至更广泛的手性分子体系,同时为其与连续化工艺的集成及工业应用提供了可能。
近年来,宛新华/张洁团队就结晶拆分这一课题开展了系统研究,具体涉及高分子添加剂的高通量筛选与制备(Angew. Chem. Int. Ed. 2021, 60, 20243-20248; Acta Polym. Sin. 2023, 54, 1498-1508),赋予不同对映体晶体不同的外观与物理性质(Angew. Chem. Int. Ed. 2018, 57, 8120-8124; Nat. Commun. 2019, 146, 9679-9687; Nat. Commun. 2021, 12, 6841; Aggregate 2021, 2, e129; J. Am. Chem. Soc. 2024, 146, 9679-9687),将天然高分子用做结晶拆分剂(Chem. Eur. J. 2024, 30, e202401550),外消旋化合物的直接结晶拆分(Cryst. Growth Des. 2025, 25, 5275-5283)等多个层面,推进了结晶拆分技术的发展,为高效、绿色、低成本、可工业化获取光学纯化合物提供了新思路与新方法。
该工作得到了国家自然科学基金(52333008, 52273002, 22405011),北京市自然科学基金(2244091),“石家庄·北京大学合作专项”联合研发项目的资助以及北京大学博雅博士后项目和北京分子科学国家研究中心BMS Junior Fellow项目的支持。