在内质网应激条件下,细胞通过未折叠蛋白反应(UPR)调控蛋白质稳态,主要通过激活IRE1α、PERK和ATF6三类感受器,降低翻译负担、增强降解能力,并上调分子伴侣表达。然而,若应激持续或超阈,UPR将由适应性响应转向促凋亡通路,诱导程序性死亡1。该机制在清除异常细胞中至关重要,但在肿瘤环境中,UPR异常激活反而可增强癌细胞生存与进展2。UPR向凋亡转变过程涉及内质网的精密调控。作为胞内应激信号枢纽,内质网通过复杂的膜网络与细胞器通讯介导死亡信号传递3。深入理解这一转变过程,需要对内质网蛋白质组进行高时空分辨的动态解析。
当前内质网蛋白组的研究主要依赖密度梯度离心等生化分离方法,但由于内质网膜系统的复杂性,常常发生胞器交叉污染,难以获得高纯度蛋白质组数据。新兴的酶促邻近标记技术(如APEX4、TurboID5)虽可实现内质网蛋白的原位捕获,但依赖转基因表达,限制了其在难转染体系中的应用,并且难以实现外源时间控制。

针对上述问题,北京大学陈鹏、樊新元等人基于前期发展的生物正交光催化概念(光催化剂用于空间靶向,外源光控用于时间分辨),进一步开发了靶向内质网的光催化邻近标记体系CAT-ER,实现了基于化学技术的内质网蛋白质动态解析,并探索了应激状态下UPR向细胞凋亡转变过程中内质网蛋白的动态调控机制(图1)。CAT-ER技术的成功开发,是光催化体系空间靶向的又一突破,也是其光催化技术体系CAT-X构建中的重要一环。该成果以Time-Resolved Photocatalytic Proximity Labeling Uncovers ER Proteome Dynamics Underlying UPR-to-Apoptosis Transition为题发表在Proc. Natl. Acad. Sci.上。

图1. CAT-ER技术示意图
首先,作者基于光催化剂在内质网的定位能力及其在体外模型中的蛋白标记效率,筛选并获得了内质网靶向的光催化剂(Ir3)以及硫代亚甲基醌探针(SF2),构建出内质网时空蛋白质组解析的光催化化学技术CAT-ER(图2)。该体系在HEK 293T细胞中的验证结果显示,其分泌途径特异性(约84%)与内质网亚分泌途径特异性(约53%)均与酶法标记相当,表明了CAT-ER能有效标记并鉴定内质网蛋白质,为其更广泛的生物学应用奠定了基础。
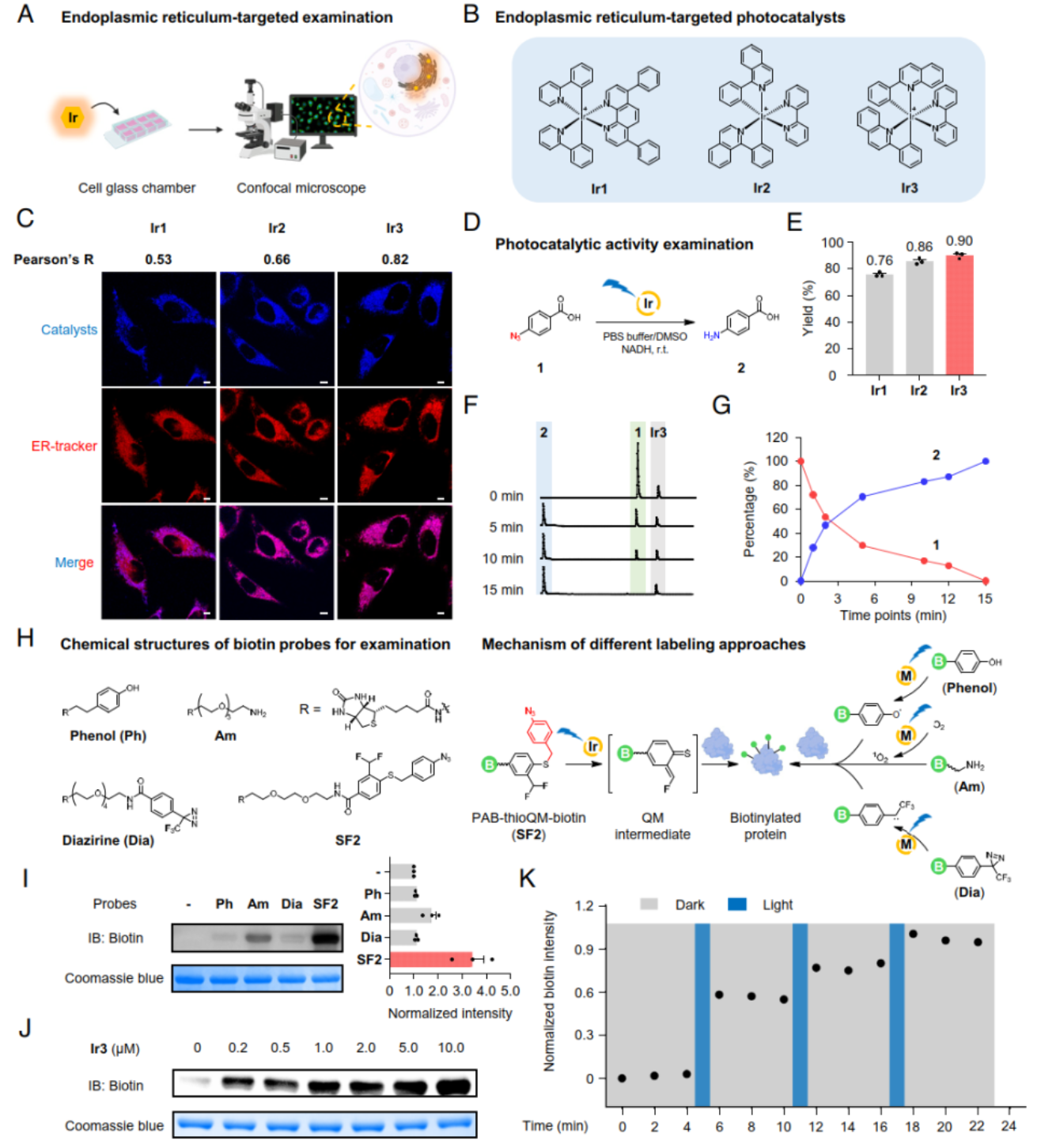
图2. CAT-ER技术的化学开发与系统构建
随后,作者将CAT-ER拓展至多种细胞类型,包括癌细胞系HeLa以及难转染的免疫细胞系(Raji、Jurkat、RAW264.7)。实验数据证明,CAT-ER 在这些体系中都展现出强大的内质网靶向能力:不仅能在多种细胞中鉴定出保守的、与蛋白质合成加工高度相关的内质网蛋白;还能在特定细胞类型中识别出与细胞生物学功能相关的蛋白质,凸显了CAT-ER在揭示不同细胞环境下复杂内质网生物学的强大实用性。
最后,作者利用 CAT-ER 的时间分辨率,动态追踪了细胞从UPR走向凋亡过程中内质网蛋白质组的变化:通过在 UPR 激活初期(2小时)和凋亡进程关键转折点(10小时)进行标记与分析,成功鉴定出不同阶段的差异调控蛋白。进一步,作者聚焦于两个阶段关键蛋白 NFIP2 和 EMC2 的功能阐释,揭示了 NFIP2 在 UPR 初期通过抑制整体翻译水平缓解内质网应激的保护作用,以及 EMC2 抑制可延缓细胞走向程序性死亡的调控机制。
总之,CAT-ER作为一种新的内质网靶向化学工具平台,凭借其独特的非酶依赖和灵活的时空可控性,为探索复杂的内质网相关生物学过程提供了创新性化学手段。该平台不仅为揭示内质网相关生理及病理过程的分子机制开辟了新思路,更进一步展现了生物正交光催化技术在邻近标记和时空组学领域的重要价值和广阔应用前景。
北京大学博士研究生周南与博士后张妍为该文的共同第一作者,樊新元和陈鹏教授为通讯作者。该研究工作得到了国家自然科学基金委、中国科技部、北京市科学技术委员会、北京医院管理中心临床医学发展基金、勃林格殷格翰青年研究员基金等项目的支持。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2503115122
参考文献
1. Hetz, C.; Papa, F. R., The Unfolded Protein Response and Cell Fate Control. Mol Cell 2018,69 (2), 169-181.
2. Chen, X.; Cubillos-Ruiz, J. R., Endoplasmic reticulum stress signals in the tumour and its microenvironment. Nat Rev Cancer 2021,21 (2), 71-88.
3. Carpio, M. A.; Means, R. E.; Brill, A. L.; Sainz, A.; Ehrlich, B. E.; Katz, S. G., BOK controls apoptosis by Ca(2+) transfer through ER-mitochondrial contact sites. Cell Rep 2021,34 (10), 108827.
4. Hung, V.; Lam, S. S.; Udeshi, N. D.; Svinkina, T.; Guzman, G.; Mootha, V. K.; Carr, S. A.; Ting, A. Y., Proteomic mapping of cytosol-facing outer mitochondrial and ER membranes in living human cells by proximity biotinylation. Elife 2017,6.
5. Branon, T. C.; Bosch, J. A.; Sanchez, A. D.; Udeshi, N. D.; Svinkina, T.; Carr, S. A.; Feldman, J. L.; Perrimon, N.; Ting, A. Y., Efficient proximity labeling in living cells and organisms with TurboID. Nat. Biotechnol. 2018,36 (9), 880-887.
排版:高杨
审核:牛林,刘志博