北京大学化学与分子工程学院应用化学系刘志博团队致力于开发放疗特异性响应的保护基团,并应用于化疗药物的前药设计中,以放疗介导的肿瘤部位化疗药物精准、可控释放,解决临床放化疗联合治疗中减毒增效的临床问题。
2024年4月1日,刘志博团队在Nature Chemistry期刊上发表了题为“Radiotherapy activates picolinium prodrugs in tumours”的新研究(图1)。该工作基于有机光致电子转移(PET)原理开发出一种新型、高效的放疗射线响应的基团,并成功应用于抗体偶联药物(ADC)的设计中,解决传统ADC药物脱靶及释放效率低的问题,初步验证了放疗响应药物技术在ADC药物设计中的应用潜力。共同第一作者是傅群峰博士,博士研究生顾郅、申思涌;通讯作者是北京大学刘志博教授。

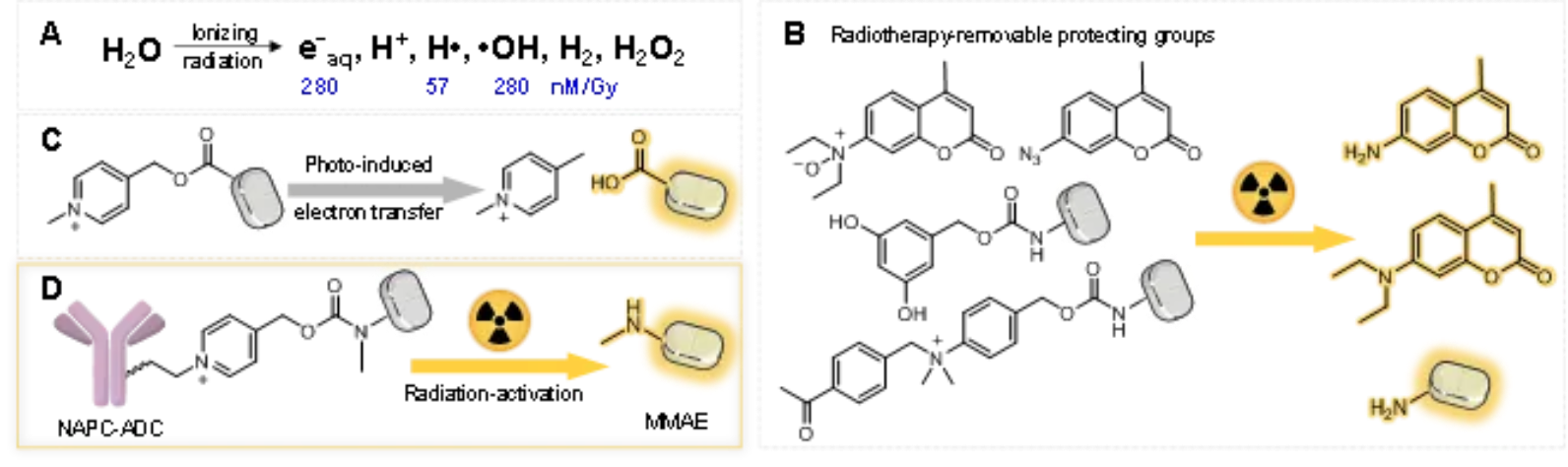
图1:放疗激活NAPC前药释放功能分子
在光致电子反应中,光敏剂接受光照后产生光电子参与化学反应。考虑到辐射产生的水合电子和光电子的相似性,研究团队通过设计筛选出反应基团NAPC,在辐射条件下实现高效脱除,并系统研究了取代基位置和电子密度对反应基团辐射还原效率的影响,提出辐射介导释放的反应机制。与已报道的放疗响应基团相比,NAPC是迄今为止效率最高、选择性最好的放疗响应基团(图 2)。

图2:筛选得到有最高反应效率的放疗射线响应基团
随即,将所开发的NAPC放疗响应策略应用于ADC药物,以适配ADC药物的精准控制释放策略,解决ADC开发中有效载荷递送脱靶和释放效率低的问题。NAPC-ADC联合X射线治疗组在抑制肿瘤生长方面表现出显著优势,且未表现出明显的副作用(图3)。
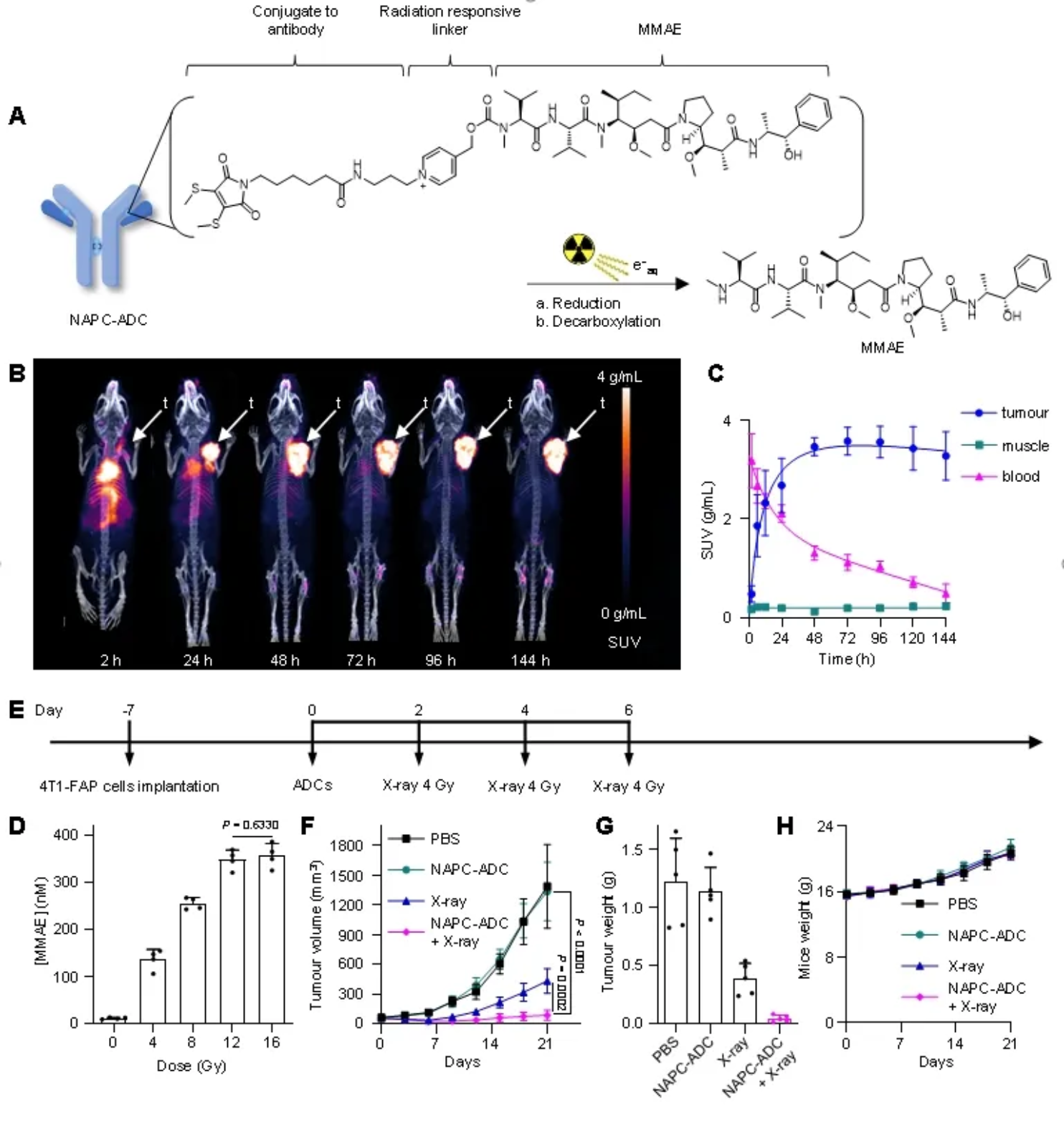
图3:NAPC放疗响应策略应用于ADC药物
该工作填补了从光化学到辐射化学领域过渡的技术空白,进一步扩充了放疗射线响应的活性基团范围。同时,刘志博团队正在从分子成药性、安全性、有效性及临床放化疗方案的适配性出发进行放疗响应药物的开发迭代与临床转化研究,有望开辟肿瘤治疗领域的新范式。
该项工作得到了北京大学化学与分子工程学院、北京分子科学国家研究中心、昌平实验室、北大-清华生命科学联合中心、国家杰出青年科学基金、中华人民共和国科学技术部、北京市自然科学基金的资助。
相关论文信息:
https://doi.org/10.1038/s41557-024-01501-4
排版:高杨
审核:牛林、彭海琳
。