靶向放射性核素治疗(targeted radionuclide therapy, TRT)作为一类新兴的癌症治疗策略,近年来受到临床医生和制药工业的广泛关注。在现有的核药物靶点中,成纤维细胞活化蛋白(fibroblast activation protein, FAP)具有肿瘤特异性高、泛癌种表达等优势,最有希望结合治疗核素实现多种肿瘤的靶向治疗。但是,受限于FAP小分子抑制剂(FAP inhibitor, FAPI)体内代谢快、肿瘤滞留时间短等不足,现有的FAP靶向治疗核药物的临床疗效并不理想。
北京大学化学与分子工程学院应用化学系刘志博团队针对FAP靶向核药物研发中存在的关键难题,基于白蛋白结合剂、三氟化硼修饰等平台技术开发了一系列核药物1-3。同时,结合213Bi、212Pb等新型自研医用核素,进行了临床前安全性和疗效的前瞻性研究,近期研究成果如下:
1. 研究团队设计开发了一系列三氟化硼修饰的FAPI,实现FAP靶向小分子的放射性诊疗转换,使其具有以下独特优势:(1)增加与FAP的相互作用,在保持体内非靶器官快速清除的同时显著提高肿瘤特异性的摄取和滞留;(2)提供稳定的18F标记位点,可进行快速简便的18F标记以指导TRT,尤其是难以被示踪的α核素治疗;(3)改善FAPI的体内药代动力学,用于低剂量TRT的同时降低副作用。该研究基于刘志博团队在国内首次报道制备的213Bi4,探索了FAP靶向213Bi核素治疗。该药物成功抑制了活体内肿瘤生长,填补了国内213Bi核药物研究的空白,揭示了短半衰期α核素在核药物研发中的独特优势5。
2. 抗体具有亲和力高、半衰期长、肿瘤摄取高等优点,与较长半衰期的治疗类放射性核素(如177Lu,225Ac)有较好的匹配。因此,团队筛选了FAP靶向抗体(PKU525)用于FAP靶向核素治疗。人源化PKU525可作为肿瘤特异性放射性核素载体用于FAP靶向核素治疗,[89Zr]Zr-PKU525的正电子成像(PET)显示其长达14天的肿瘤滞留时间与高度的特异性。在动物模型上,[177Lu]Lu-PKU525展现了显著的肿瘤抑制作用,且毒副作用较低,具有良好的临床转化前景6。
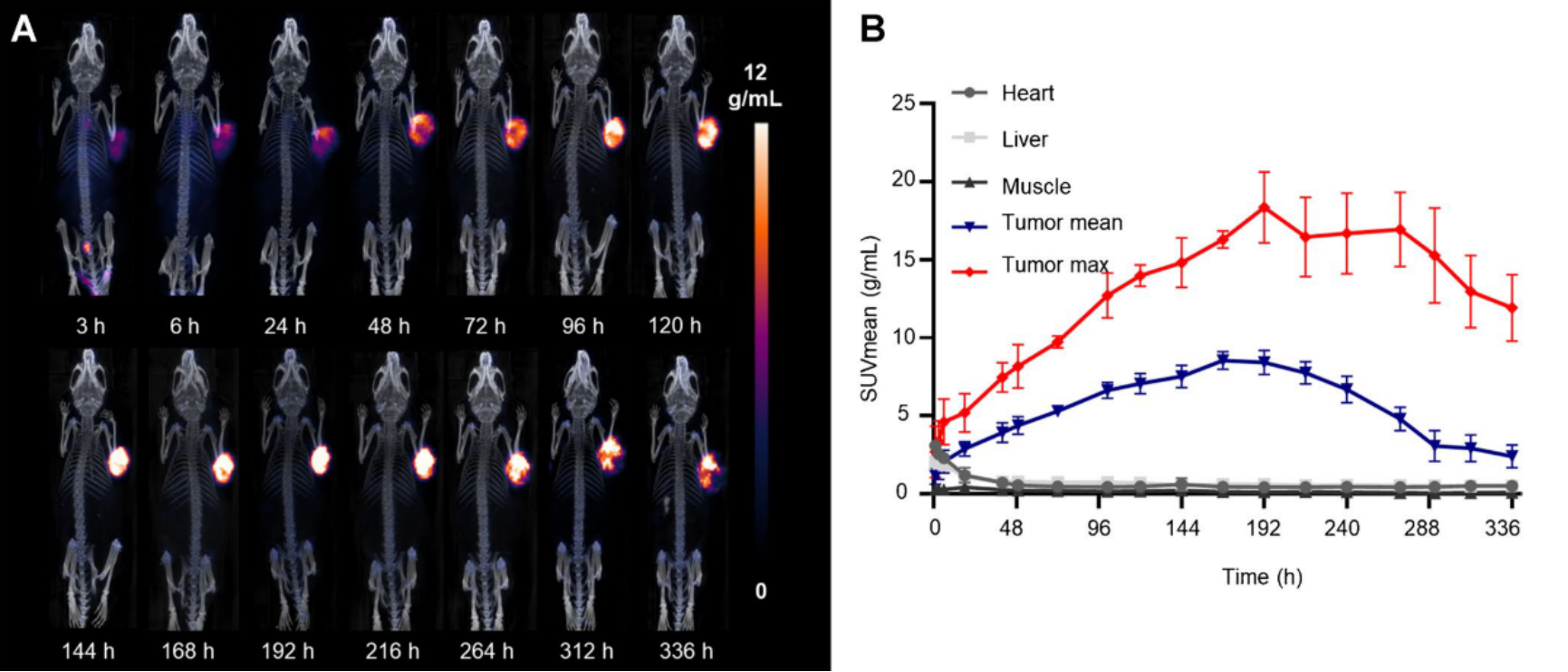
图一:PKU525在荷瘤小鼠中的长时间PET成像
3. 靶向α核素治疗通过核素衰变产生的数MeV高能α粒子实现高效的肿瘤细胞杀伤效果,且其较短的射程将有效减少对周围健康组织的损伤。225Ac是一种极具潜力的α治疗核素,在一次衰变中发射4个α粒子和2个β粒子。团队成功构建了稳定、高效的[225Ac]Ac-PKU525放射性标记体系,在多个肿瘤模型中表现出良好的治疗效果和安全性,治疗剂量仅为相关β核药物的千分之一7。
近年来,刘志博团队基于FAP靶向核药物领域的创新成果,与北京肿瘤医院、北京协和医院、医科院肿瘤医院、西京医院、兰大二院等临床机构开展了积极的临床转化研究,多个药物分子进入产业开发阶段。以上研究获得国家自然科学基金、科技部重点研发计划、北京大学、北京分子科学国家研究中心、北大-清华生命科学联合中心、北京自然科学基金、苏州博锐创合的资助,并得到了北京大学分析测试中心等的支持。
论文:
1. J Nucl Med. 2022;63(6):952-8. doi: 10.2967/jnumed.121.262533.
2. Eur J Nucl Med Mol Imaging. 2022;49(6):1985-96. doi: 10.1007/s00259-021-05591-x.
3. Mol Pharm. 2022;19(9):3429-38. doi: 10.1021/acs.molpharmaceut.2c00579.
4. 中华核医学与分子影像. 2022;42(6):330-4. doi: 10.3760/cma.j.cn321828-20220210-00038.
5. Eur J Nucl Med Mol Imaging. 2023. doi: 10.1007/s00259-023-06230-3.
6. Eur J Nucl Med Mol Imaging. 2023. doi: 10.1007/s00259-023-06300-6.
7. Chem. Biomed. Imaging. 2023. doi: 10.1021/cbmi.3c00067.
图文:刘志博课题组
审核:牛林、彭海琳
排版:牛林、高杨