【摘要】近日,北京大学化学与分子工程学院彭海琳课题组、清华大学生命科学学院王宏伟课题组和北京大学工学院韦小丁课题组合作在《自然-方法学》 (Nature Methods)发表了题为“Uniform thin ice on ultraflat graphene for high-resolution cryo-EM”的研究论文,报道了新型超平整石墨烯电镜载网,破解了高分辨冷冻电镜表征中均匀薄冰的制备难题。该工作表明,超平整石墨烯/均匀薄冰支撑膜能显著提升冷冻电镜成像质量和效率,实现多种小蛋白(分子量小于70 kDa)的高分辨三维重构。
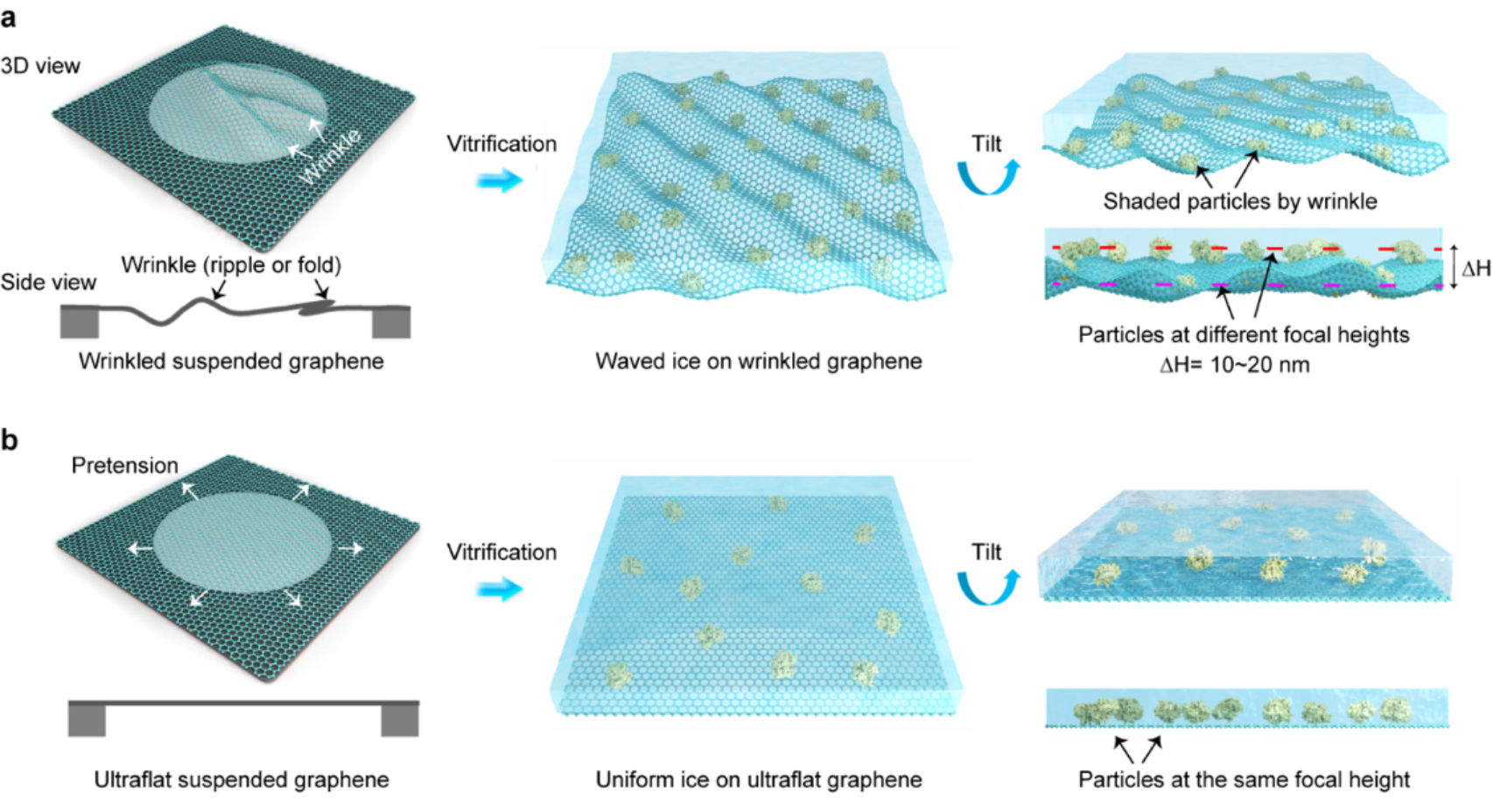
图1悬空石墨烯冷冻电镜支撑膜的平整度影响冰层厚度均一性和成像质量
单颗粒冷冻电镜是目前揭示生物大分子精细结构和反应机理的重要手段之一。在冷冻电镜成像过程中,生物大分子被封装在薄层玻璃态冰中,在电子束辐照下,仍处于原始结构和本征状态。实验表明,均匀薄冰层的制备是实现高分辨冷冻电镜成像的关键因素之一,尤其是对于分子量较小的蛋白(小于100 kDa),因为冰层过厚会严重影响信噪比,无法实现高分辨率结构重构。然而,样品制备过程中,冰层厚度和均一性目前仍难以精确控制,已成为高分辨冷冻成像的主要挑战之一。
针对该关键问题,北京大学彭海琳课题组、清华大学王宏伟课题组及北京大学韦小丁课题组合作,揭示了冷冻电镜样品支撑膜的表面粗糙度和冰层均一性的关系,并开发了超平整石墨烯电镜载网,解决了均匀薄冰的制备难题。研究表明,超平整石墨烯支撑膜能形成更薄更均匀的玻璃态冰,背景衬度低,有利于高信噪比和高分辨率的冷冻电镜成像。基于超平整石墨烯/均匀薄冰支撑膜,他们对三种分子量较小的链霉亲和素蛋白(streptavidin,52 kDa)、血红蛋白(hemoglobin,64 kDa)和甲胎蛋白(α-fetoprotein,67 kDa)进行结构解析,分别得到了2.2 Å、3.5 Å和2.6 Å的高分辨率重构。进一步的,他们还证明该超平整石墨烯载网在冷冻电子断层扫描(cryo-ET)等领域有良好的应用前景。
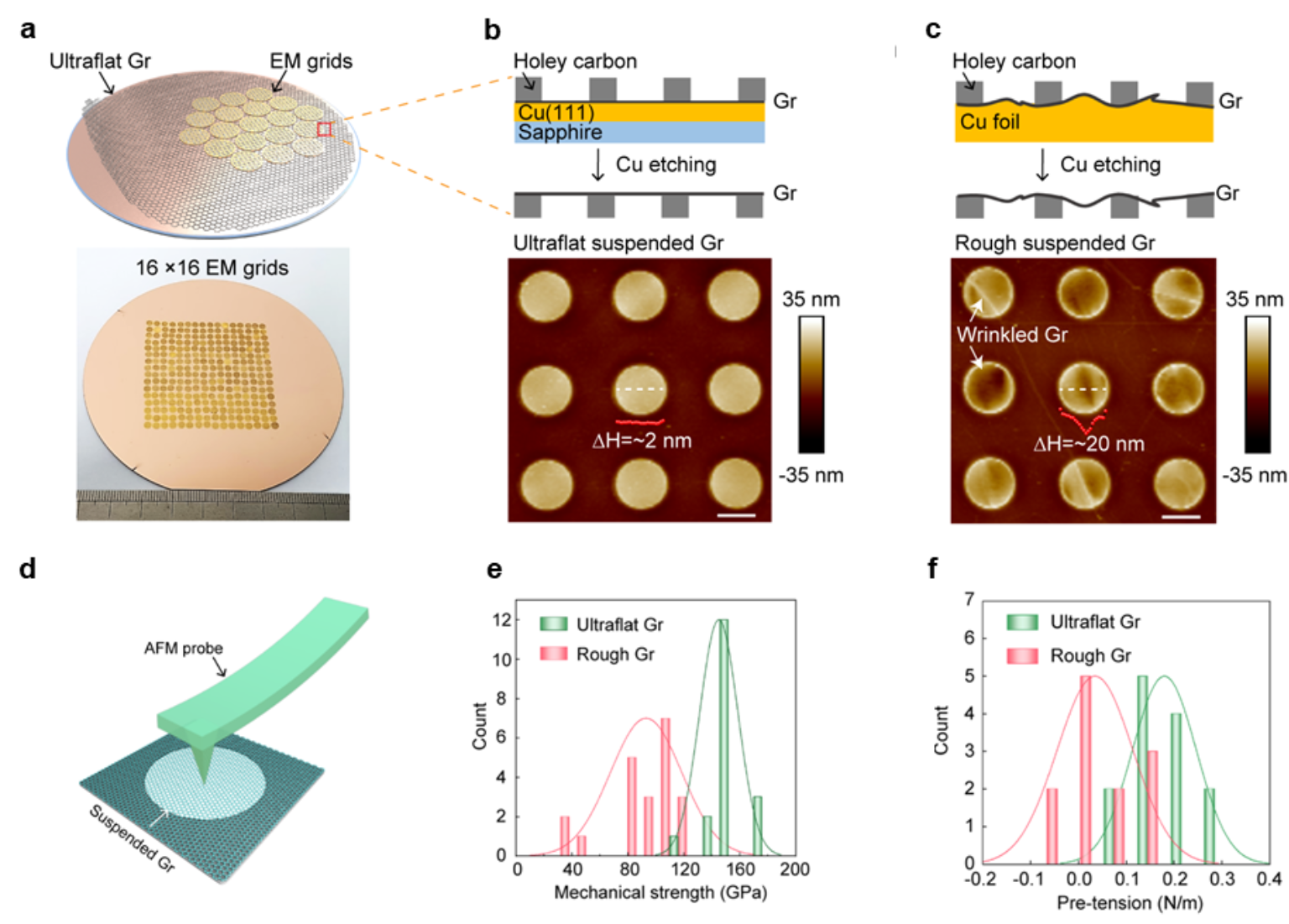
图2 超平整石墨烯载网的设计、制备与力学性质表征
彭海琳课题组与刘忠范课题组前期合作开发了铜(111)/蓝宝石晶圆上超平整石墨烯单晶的外延生长方法和批量制备技术。在此基础上,彭海琳课题组基于超平整石墨烯单晶晶圆和“面对面”超洁净无胶转移方法,成功实现了超平整悬空石墨烯电镜载网的批量化制备,单层石墨烯悬空膜完整度高达98%,平均表面粗糙度低至0.7 nm。原子力显微镜(AFM)纳米压痕技术的力学表征结果表明,超平整石墨烯支撑膜具有接近于石墨烯理论值的杨氏模量和断裂强度,远高于粗糙起伏有褶皱的石墨烯。进一步分析表明,超平整石墨烯支撑膜具有约0.2 N/m的预应力,而预应力是制备均匀薄冰的关键因素。冷冻制样过程中,在滴加样品溶液后,需要用滤纸吸走支撑膜上的多余液体以制备薄层液膜。该过程会产生很大的剪切力(kPa量级),导致样品液膜产生起伏,进而造成冰层的起伏。超平整石墨烯中预应力的存在使其能抵消剪切力产生的影响,即使在100 kPa的剪切力下依然保持平整。
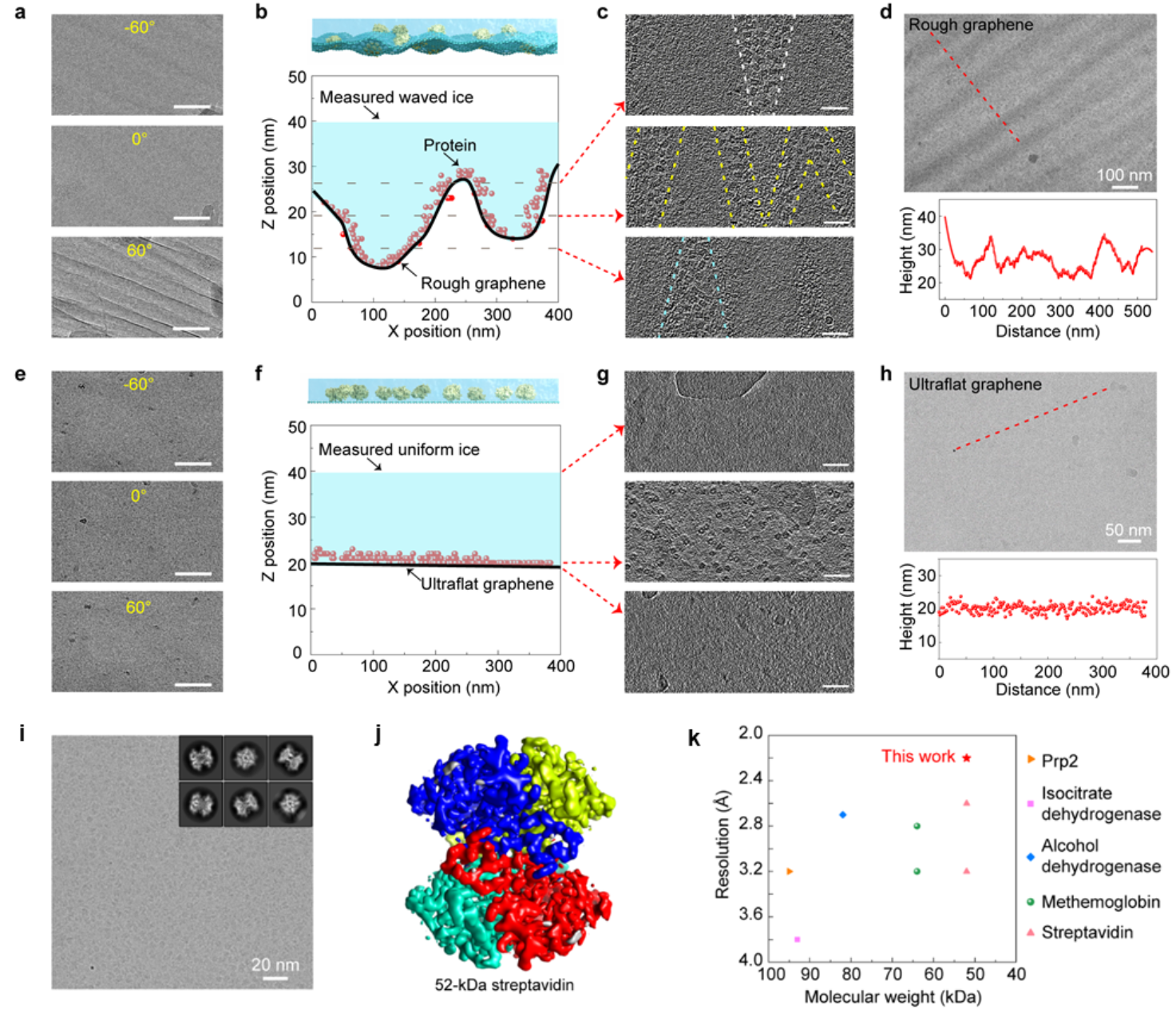
图3超平整石墨烯显著提高冷冻电镜成像质量,成功解析streptavidin(52 kDa)的高分辨三维重构
他们将超平整石墨烯载网用于冷冻电镜成像中,发现形成的均匀薄冰能显著提高成像质量。一方面,预应力使得冰层在电子束辐照下不易发生翘曲,有效抑制了样品在表征时的漂移。另一方面,在不同的倾转角度下(-60°~60°),石墨烯表面均无褶皱结构,避免了高角度成像时褶皱对样品信号的遮蔽。经过测量,超平整石墨烯支撑膜所制备的冰层厚度约为20 nm,且厚度比较均匀,既可有效封装生物大分子颗粒,也不会过多引入额外的背景噪音。大多数生物大分子颗粒吸附于石墨烯表面,几乎处于同一高度,降低了成像时同一视野下局部欠焦值的差异。与粗糙起伏的石墨烯对比,超平整石墨烯保证了高质量数据的收集,提升了成像效率。综合以上优势,作者利用新型超平整石墨烯载网对三种小蛋白streptavidin(链霉亲和素蛋白,52 kDa)、hemoglobin(血红蛋白,64 kDa)和α-fetoprotein(甲胎蛋白,67 kDa)进行冷冻电镜结构解析,分别得到了2.2 Å、3.5 Å和2.6 Å的高分辨率结构重构。
该研究工作以“超平整石墨烯/均匀薄冰支撑膜用于高分辨冷冻电镜成像”(Uniform thin ice on ultraflat graphene for high-resolution cryo-EM)为题,于2022年12月15日发表在《自然-方法学》(NatureMethods)。北京大学化学与分子工程学院彭海琳教授、清华大学生命科学学院王宏伟教授、刘楠博士以及北京大学工学院韦小丁教授为论文共同通讯作者,北京大学化学与分子工程学院博士毕业生郑黎明、清华大学生命科学学院刘楠博士、北京大学化学与分子工程学院博士生高啸寅以及北京大学工学院博士毕业生朱文清为论文共同第一作者。该工作得到国家自然科学基金、国家重大科学研究计划、北京分子科学国家研究中心、北京生物结构前沿研究中心、清华-北大生命科学联合中心、中国博士后科学基金、腾讯基金会等资助,并得到了北京大学化学与分子工程学院的分子材料与纳米加工实验室(MMNL)仪器平台的支持。
论文链接:https://www.nature.com/articles/s41592-022-01693-y
排版:高杨