近期,北京大学化学与分子工程学院雷晓光教授与北京大学生命科学学院肖俊宇研究员、南方科技大学田瑞军教授在eLife杂志上发表了最新合作研究成果“Selective inhibition reveals the regulatory function of DYRK2 in protein synthesis and calcium entry”。该工作报道了新一代高活性、高选择性DYRK2激酶小分子抑制剂的开发,以及利用该抑制剂作为工具分子通过化学生物学手段首次揭示了该激酶对蛋白合成及钙内流的关键调控作用。
人体双特异性酪氨酸-磷酸化调控激酶DYRKs是进化保守的激酶家族,以对其自身的酪氨酸残基和其他蛋白的丝氨酸/苏氨酸位点具有激酶活性为主要特点。DYRKs属于丝氨酸/苏氨酸CMGC激酶家族,共有五个成员。DYRK2是DYRKs家族的主要成员之一,但其生理功能尚未被完全揭示。近期研究表明双特异性酪氨酸磷酸化调控激酶2(DYRK2)是一个蛋白酶体调控激酶。抑制DYRK2激酶能够显著降低蛋白酶体活性,导致小鼠异种移植模型中肿瘤细胞周期进展受阻、生长减缓。
在前期研究中,雷晓光、肖俊宇课题组与合作者报道了DYRK2特异性小分子抑制,LDN192960 (PNAS 2019)。晶体结构解析和生化研究揭示了LDN192960 选择性抑制DYRK2的分子机制。LDN192960能够通过抑制DYRK2的活性而降低蛋白酶体活性,从而缓解三阴性乳腺癌和多发性骨髓瘤的进展,表明靶向DYRK2有望成为治疗这两种肿瘤的有效方案。虽然LDN192960对于DYRK2有较好的选择性和抑制性,但是它还可以抑制其他相关激酶,包括Haspin和DYRK3。
为了消除脱靶激酶的影响,该工作通过基于结构的药物设计,在基于吖啶的核心结构基础上设计、合成和评估了一系列新型吖啶类似物,并解析了11个新型小分子抑制剂与DYRK2的共晶结构。其中化合物17(C17)表现突出,对DYRK2具有纳摩级别的半抑制浓度(IC50),并对其他468个人体激酶没有明显的活性。此外,C17还有效的抑制了细胞中DYRK2的活性。因此,C17是一种高效且极具选择性的DYRK2抑制剂。
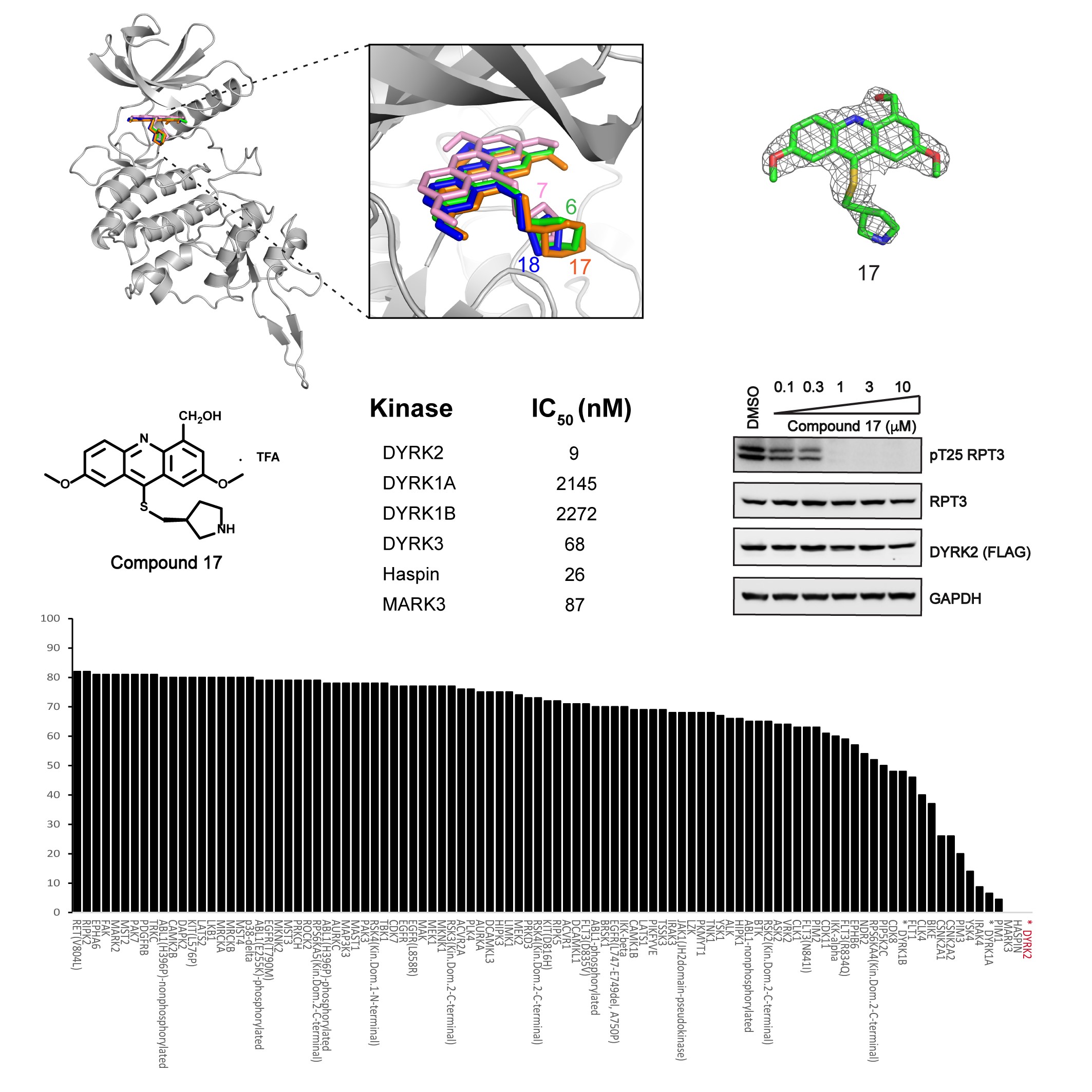
图1 C17是一个高活性、高选择性的DYRK2小分子抑制剂
为了发现DYRK2新的生物学功能,该工作将C17作为一个特异而有效的探针,来研究哪些蛋白或信号通路受到DYRK2调控的影响。通过使用无标记的定量磷蛋白组学方法研究了C17处理后细胞磷酸化蛋白组的变化。在此,该研究通过对DYRK2的mRNA含量测序,寻找了一株在内源DYRK2基因高表达的骨髓瘤细胞系(U266)进行磷酸化蛋白质组学分析。结果表明,DYRK2参与复杂的磷酸化网络,通过直接、间接的作用调节蛋白质的磷酸化状态。在显著下调的位点中,该工作重点关注了两个重要的潜在底物蛋白,真核翻译起始因子结合蛋白1(4E-BP1)和基质相互作用分子1(STIM1)。

图2 基于C17的定量磷酸化蛋白质组学分析
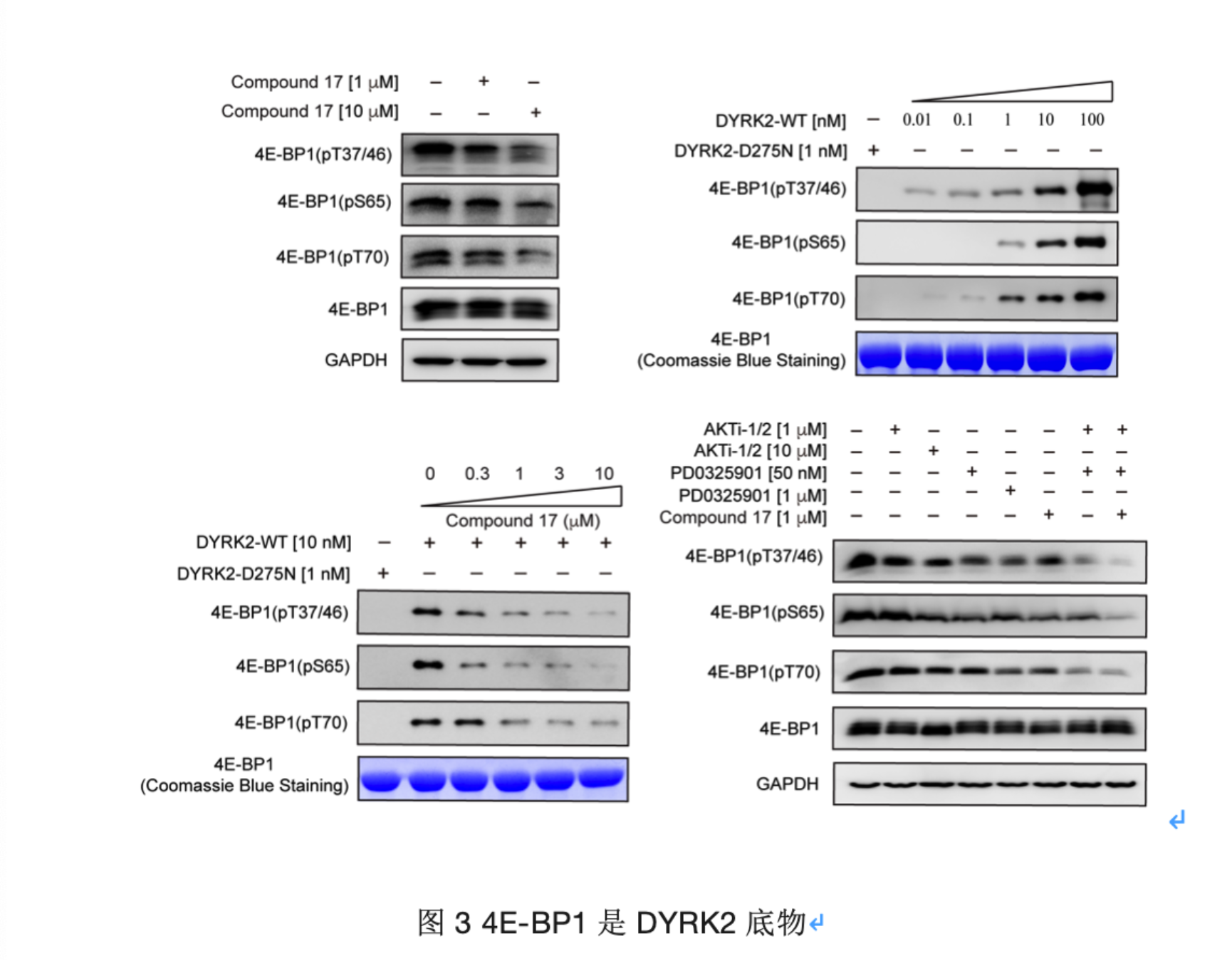
4E-BP1是转录过程的重要调节因子,已有研究表明是DYRK2的潜在底物。该研究通过建立体外激酶活性体系,验证了DYRK2可以直接磷酸化4E-BP1上的多个位点(包括质谱鉴定到的位点Thr37),并且C17以剂量依赖性的方式抑制这些位点。此外,4E-BP1受多种激酶的共同调节,进一步研究表明,当C17与AKT、MEK抑制剂联用时,可以更高效地抑制蛋白磷酸化水平,表现出不同抑制剂之间的协同效应。总之,通过大量的体内外实验验证,结果表明4EBP1是DYRK2的直接底物,并揭示了DYRK2 抑制剂与其他激酶抑制剂联合用于癌症治疗的潜在用途。
STIM1是已知的磷酸化蛋白,其磷酸化可以调控钙库操纵的钙内流过程(SOCE)。该研究同样验证了DYRK2在蛋白水平、细胞内都可以有效的磷酸化STIM1,这些结果表明STIM1中可能存在多个DYRK2磷酸化位点。据此,该研究进一步通过质谱鉴定到DYRK2作用STIM1的具体位点,包括U266磷酸化蛋白组分析中确定的Ser519和Ser521。为了进一步验证DYRK2对STIM1的磷酸化修饰的功能,通过Co-IP、FRET体系验证了DYRK2通过对STIM1的磷酸化修饰增强其与Orai1之间的结合能力,而DYRK2-D275N,STIM1-1-491以及STIM1-10M则不能,且处理C17则可以减弱STIM1和Orai1的相互作用。进一步研究证明,DYRK2磷酸化可以促进STIM1寡聚,增强与Orai1的相互作用,进而诱导SOCE过程。
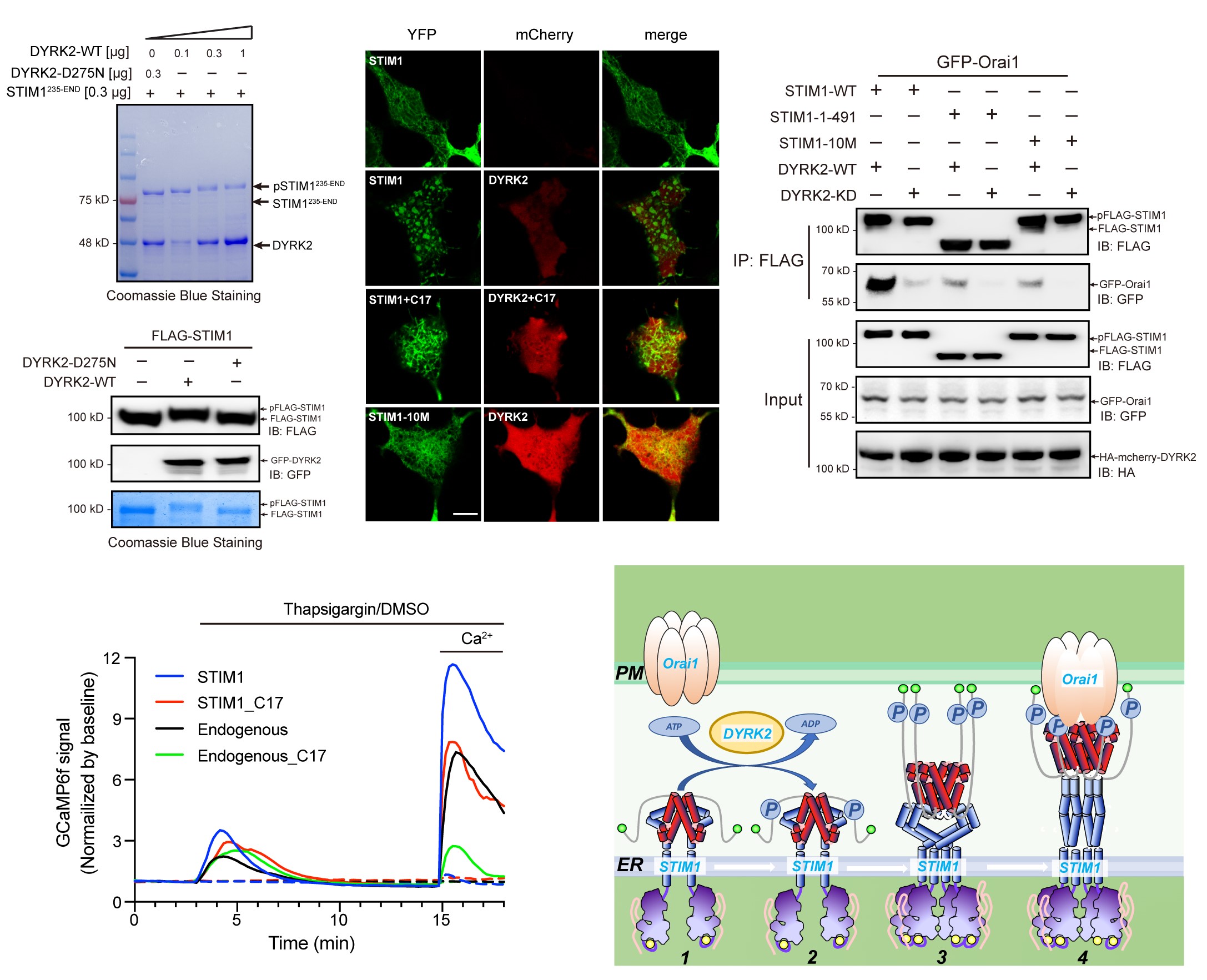
图4 DYRK2磷酸化STIM1并参与调控钙库操纵的钙内流过程
该研究结合结构生物学与化学生物学方法,系统研究和开发了一系列新型DYRK2激酶小分子抑制剂。这些研究为靶向DYRK2的药物开发提供了实验数据和理论参考,也更加拓展了对DYRK2生物学功能的理解,为其后续研究提供了有力的分子工具。
该工作中,北京大学魏田田博士、王珏博士、梁如琪博士以及南方科技大学陈文东博士为该论文的共同第一作者,北京大学雷晓光教授和肖俊宇研究员,以及南方科技大学田瑞军教授为文章的共同通讯作者。北京师范大学博士研究生陈一兰、北京大学博士研究生曾欣、杜逸飞博士、南方科技大学何岸博士、北京大学周文静博士、浙江大学郭行教授、北京大学陈晓伟研究员、北京大学王初教授以及北京师范大学王友军教授对该工作提供了帮助。该工作的晶体筛选在北京大学凤凰工程蛋白质平台完成,晶体数据收集在上海同步辐射光源和日本KEK同步辐射光源完成。该工作主要得到国家科技部重点研发计划-蛋白质机器专项,国家自然科学基金委-“生物大分子动态修饰与化学干预”重大研究计划,北京市卓越青年科学家计划,北京分子科学国家研究中心,北大-清华生命科学联合中心等科研基金的资助。
原文链接:https://elifesciences.org/articles/77696