近日,北京大学化学与分子工程学院、北大-清华生命联合中心王初课题组在Journal of American Chemical Society杂志上发表题为“Quantitative Site-Specific Chemoproteomic Profiling of Protein Lipoylation”的研究文章。在这项工作中,作者发展了新型的用于捕获硫辛酰化修饰的化学探针,并结合定量化学蛋白质组学的技术,首次实现在大肠杆菌和哺乳动物细胞中的硫辛酰化修饰位点全局性鉴定与定量,并对大肠杆菌中特定底物蛋白中三个硫辛酰化修饰位点的调控和硫辛酰化修饰合成酶的功能进行了研究。
硫辛酰化修饰是一种通过酰胺键将硫辛酸共价连接到蛋白质赖氨酸残基上的翻译后修饰。硫辛酰化修饰在进化中高度保守,并且位于细菌和哺乳细胞核心代谢途径几种重要蛋白质复合物的活性口袋中,作为关键辅因子发挥着重要的催化作用。硫辛酰化修饰的失调与人类代谢紊乱、癌症等疾病相关。因此,加深对硫辛酰化修饰调节的理解对于研究与这些疾病相关分子机制具有重要的意义。
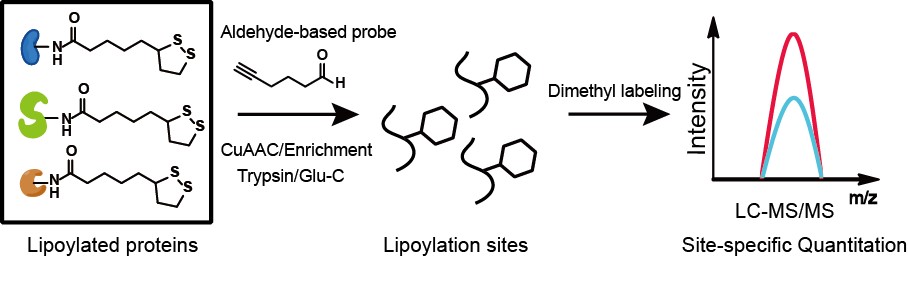
本工作发展了一种标记硫辛酰化修饰的探针和一套具有位点分辨率的定量化学蛋白质组技术。作者受醛基基团保护策略中常用的基于硫缩醛的方法启发,设计了丁醛探针BAP。该探针中含有醛基,可与硫辛酰化修饰发生缩合反应,并结合生物正交基团炔基,通过铜催化的点击化学反应引入可切割的富集标签。作者结合底物序列分析结果,使用V8蛋白内切酶可以实现了对大肠杆菌中所有已知硫辛酰化修饰位点的鉴定。
利用发展的大肠杆菌硫辛酰化修饰位点定量策略,本工作发现底物蛋白ODP2中三个硫辛酰化修饰位点在体内的调控是相对独立的,并且当体内感受到整体的硫辛酰化修饰降低到一定限度时,会启动一定的补偿调控机制。作者进一步在大肠杆菌中探究了硫辛酰化修饰从头合成途径和硫辛酰化修饰直接合成途径在硫辛酰化修饰合成过程的重要性。通过对三个硫辛酰化修饰合成酶进行敲除,作者发现从头合成途径比直接合成途径起了更重要的作用。
最后,作者进一步将该定量化学蛋白质组学流程运用到哺乳细胞体系中。利用新型的电离辅助亲和标签CY58,结合二甲基化标记定量策略,作者成功地实现了对人源细胞中所有已知的六个硫辛酰化修饰位点进行定量,有望对不同类型生物样本中的硫辛酰化修饰水平进行测定。
该文的通讯作者为北京大学化学与分子工程学院、北大-清华生命联合中心的王初教授。其指导的化学与分子工程学院2016级博士研究生赖书畅和博士后陈颖博士为该文的共同第一作者。王初课题组杨帆博士,肖伟弟博士和刘源博士等合作者为该课题做出了重要的贡献。该工作得到了基金委、北京分子科学国家研究中心、教育部生物有机和分子工程重点实验室、北大-清华生命联合中心的经费支持。
文章链接:https://pubs.acs.org/doi/10.1021/jacs.2c01528