线粒体作为细胞的能量工厂在多个信号通路以及多种疾病的发生发展中扮演了相当重要的角色。对线粒体蛋白质组进行多维度的解析能够使我们更深入地了解它的功能。然而,现有的线粒体蛋白质组学技术存在相应的缺陷。其中,通过密度梯度离心得到的线粒体容易被其他细胞器污染,且对分离后的线粒体进行蛋白质组学分析不能够反映活细胞内的真实情况。酶促邻近标记以及亚细胞定位的活性化学分子标记技术常用于活细胞中的线粒体蛋白质组学分析,然而这两种技术分别受限于质粒转染的操作难度以及活性化学分子的非特异性标记。
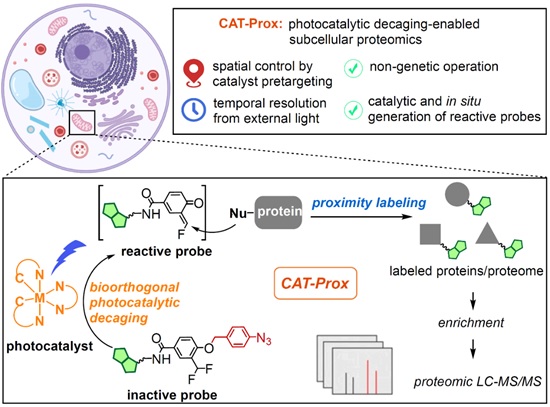
图1. CAT-Prox技术示意图
近日,北京大学化学与分子工程学院陈鹏/樊新元团队报道了一种基于光催化的生物正交反应的新一代线粒体蛋白质组学技术CAT-Prox(Photocatalytic decaging-enabled proximity labeling strategy)。该研究利用光催化的生物正交反应的独特优势,提出光敏剂靶向线粒体和可见光外源控制的“化学-光控”协同策略,在活细胞的线粒体中原位催化产生活性化学探针,用于线粒体蛋白质组的原位、实时标记,实现了无需基因操作、时空灵活可控的线粒体蛋白质的原位标记,在难以基因操作的细胞中实现了高特异的线粒体蛋白质组学的“时-空”分析。
作者首先将响应蓝光照射的光催化剂定位至线粒体,随后向细胞中加入叠氮苯基保护的亚甲基醌化合物。其中,叠氮苯基能够在蓝光的照射下被光催化剂催化还原并离去,原位生成高亲电性的亚甲基醌中间体,实现线粒体蛋白质的特异性标记。最后,作者通过选择性富集和串联质谱分析被特异性标记的线粒体蛋白质,实现高覆盖率、高特异性以及时空分辨的线粒体蛋白质组学分析。结果表明,该方法在HeLa细胞以及更难转染的RAW264.7细胞中能够鉴定到超过200个线粒体蛋白质,特异性高达70%。此外,作者还利用这一策略在炎症刺激下的RAW264.7细胞中实现了线粒体蛋白质组的动态分析,除了能够高特异性地鉴定线粒体蛋白质以外还能够对它们在炎症刺激前后的丰度变化进行监测,实现多维度的线粒体蛋白质组学分析。
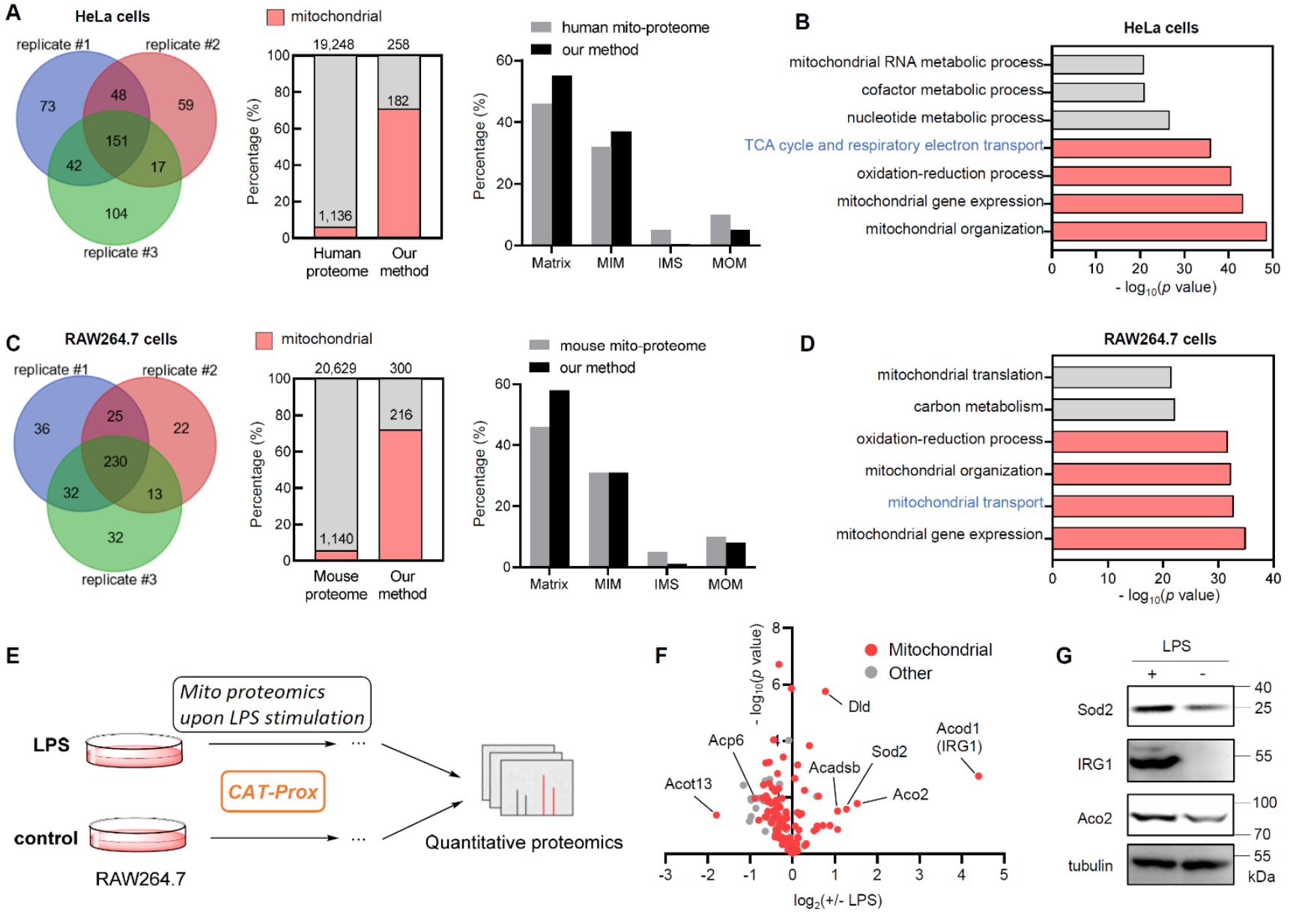
图2. 线粒体蛋白质组的串联质谱分析结果
综上,该项研究开发了基于光催化的生物正交剪切反应以及邻近标记的线粒体蛋白质组学技术CAT-Prox。该技术在不需要质粒转染的情况下实现了时空分辨的线粒体蛋白质组学分析,为日后在活体中进一步研究亚细胞区域的动态蛋白质组打下了坚实的基础,从而能够更深入更细致地对生物学过程进行解析。该研究成果近日以“Bioorthogonal Photocatalytic Decaging-Enabled Mitochondrial Proteomics”为题发表于Journal of the American Chemical Society (https://doi.org/10.1021/jacs.1c09171)。
北京大学化学与分子工程学院博士研究生黄宗煜、刘子琦为该论文的共同第一作者,北京大学化学与分子工程学院、北大-清华生命科学联合中心陈鹏教授和北京大学化学与分子工程学院的樊新元副研究员为该论文的共同通讯作者。该工作得到了国家自然科学基金委、科技部、北京分子科学国家研究中心以及北大-清华生命科学联合中心的资助。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.1c09171