作为一种生活中的常见致癌物,甲醛会对人体产生很大的危害。但另一方面,生物体本身也产生一定量的甲醛。这些“内源”甲醛分子是多条生理代谢途径的原料或产物,与细胞的存活与生长密切相关。有研究显示,作为一碳化合物,甲醛能够被纳入一碳循环(one-carbon-cycle),用于DNA与必需氨基酸的合成(Burgos-Barragan, G. et al. Nature, 2017, 548, 549–554)。虽然甲醛的这些生理功能逐渐被揭示,与甲醛相关的许多疑问仍有待探索。例如,细胞是通过何种机制来特异识别和感知内源甲醛的浓度?甲醛对应的信号是如何在细胞内传递,产生响应,并避免甲醛造成的损伤?我们又能否对细胞内的甲醛动态分布进行精准探测,以揭示甲醛的生理功能呢?
针对上述问题,北京大学化学与分子工程学院、北大-清华生命科学联合中心陈鹏课题组着手对一个独特的甲醛响应的转录因子HxlR进行了深入研究,首次从结构与化学机理上揭示了甲醛诱导HxlR蛋白发生分子内交联反应,所产生的“亚甲基桥”(methylene bridge)这一特殊化学修饰使HxlR产生功能获得性(gain-of-function)生理响应。基于这一发现,他们开发了首个可遗传编码的甲醛荧光探针(FAsor),成功应用于检测活细胞以及小鼠脑组织切片中甲醛的动态变化。相关成果于2021年1月25日在线发表在《自然-通讯》杂志(Nature Communications),“Genetically encoded formaldehyde sensors inspired by a protein intra-helical crosslinking reaction” (DOI:10.1038/s41467-020-20754-4)。
甲醛对于生物学和化学领域的研究者来说并不陌生。如果思考这样一个问题,甲醛与蛋白质会发生什么化学反应?答案可能是,甲醛能够与蛋白质上的亲核性氨基酸侧链发生加成反应;甲醛作为蛋白质交联试剂,能够在蛋白质的亲核性残基(如赖氨酸)之间形成交联,使蛋白质变性失活。然而,甲醛使蛋白质变性的原因不能与细胞响应甲醛的机制划等号。首先,使蛋白质变性的甲醛浓度远高于细胞内源甲醛的浓度范围;其次,甲醛使蛋白质变性是一种非特异性的、损伤性的过程,这很难作为细胞精确响应和调控生理水平甲醛的工作机制。因此,甲醛在细胞中有哪些特异性的响应模式,这些响应是通过什么样的分子机制实现的,仍是一个未知的问题。在枯草芽孢杆菌发现的HxlR蛋白是一种转录激活因子,能够在甲醛刺激下激活下游基因转录,进行功能获得性(gain-of-function)的生理响应(Yurimoto, H. et al. Mol. Microbiol., 2005, 57, 511–519)。受HxlR这一特性的吸引,研究团队选择HxlR蛋白以探究其“特异”响应甲醛分子的机制。
首先,为了确认HxlR蛋白直接与甲醛发生了化学反应,研究团队结合质谱分析与X射线晶体学研究了HxlR与甲醛的相互作用。HxlR与甲醛共孵育后的质谱分析显示,甲醛能够使HxlR发生+12 Da的分子量偏移。这一变化与甲醛诱导的亚甲基桥连一致,说明HxlR很有可能直接与甲醛发生了反应。进一步的二级质谱肽段鉴定,以及HxlR-甲醛共晶结构解析共同佐证了这一点。两者的结果均显示,与甲醛反应之后,位于HxlR蛋白N端第一个α螺旋的半胱氨酸(Cys11)与赖氨酸(Lys13)残基之间形成了位点特异的“亚甲基桥”。针对这一发现,研究团队又通过位点突变来确认该交联反应与HxlR蛋白功能的联系。结果显示,无论突变哪一个位点(C11A或K13A),HxlR都将失去响应甲醛的能力。这说明HxlR蛋白的确通过Cys11和Lys13特异性识别甲醛,形成亚甲基桥这一独特的化学修饰,实现转录功能的激活。
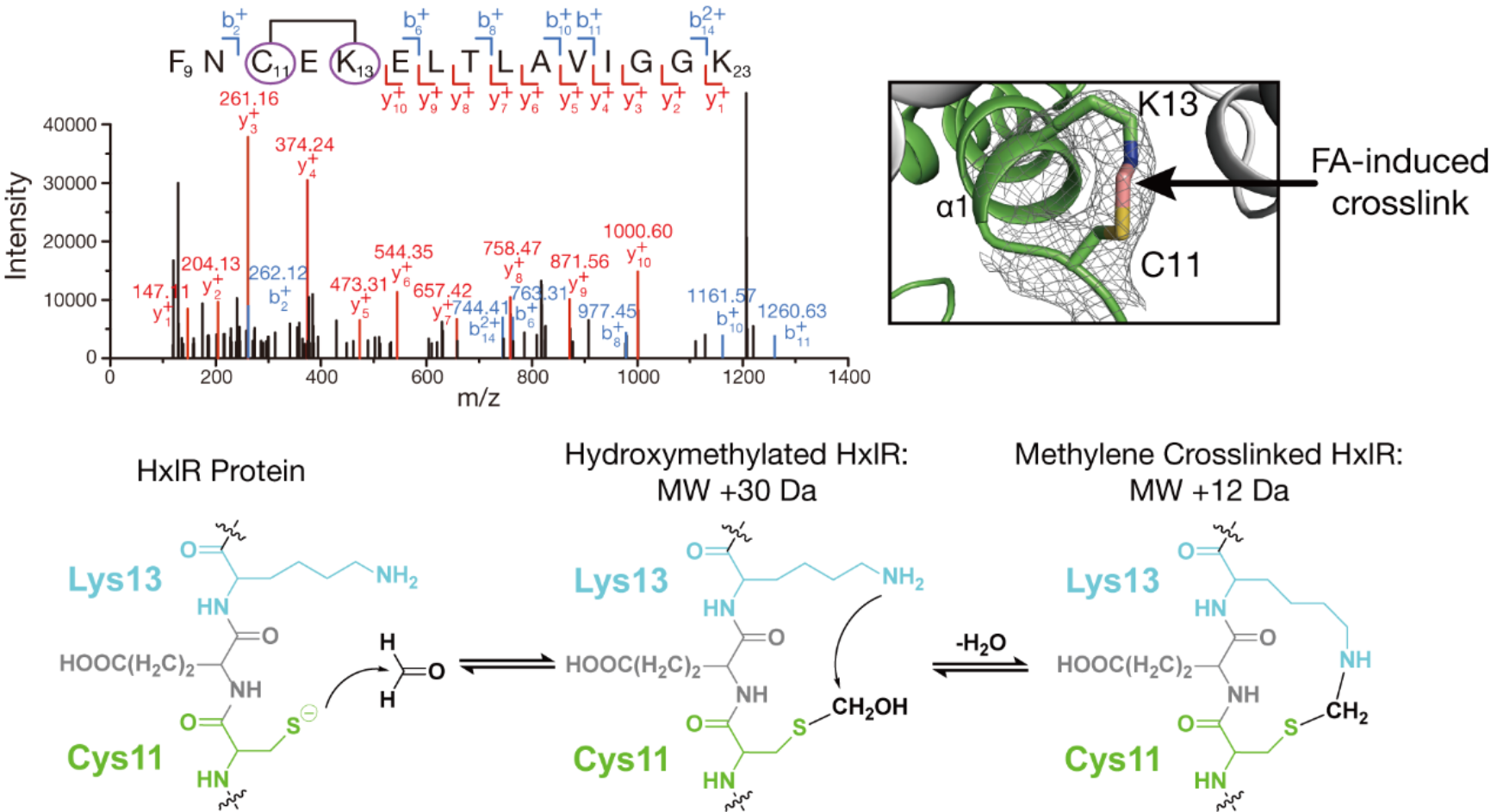
甲醛与HxlR蛋白位点特异性反应形成分子内“亚甲基桥”
那么甲醛诱导的分子内交联又是如何实现对HxlR蛋白功能的激活?研究团队接下来仔细分析了不同处理条件与突变体的HxlR蛋白晶体结构。通过对甲醛处理前后的HxlR结构对比,他们发现看似简单的亚甲基桥却引起了蛋白整体构象的极大变化!甲醛诱导的Cys11-Lys13亚甲基桥迫使原本位于同一α螺旋两侧的两个氨基酸侧链相互靠近,扭曲了α螺旋结构,并“牵一发而动全身”,带动HxlR蛋白N端主链朝向翻转(N-terminal flipping),使得蛋白整体构象发生改变,极大地增强HxlR蛋白与DNA的结合能力,激活下游基因的转录。至此,研究团队揭示了HxlR特异性响应甲醛并发生结构与功能转换的分子机制。
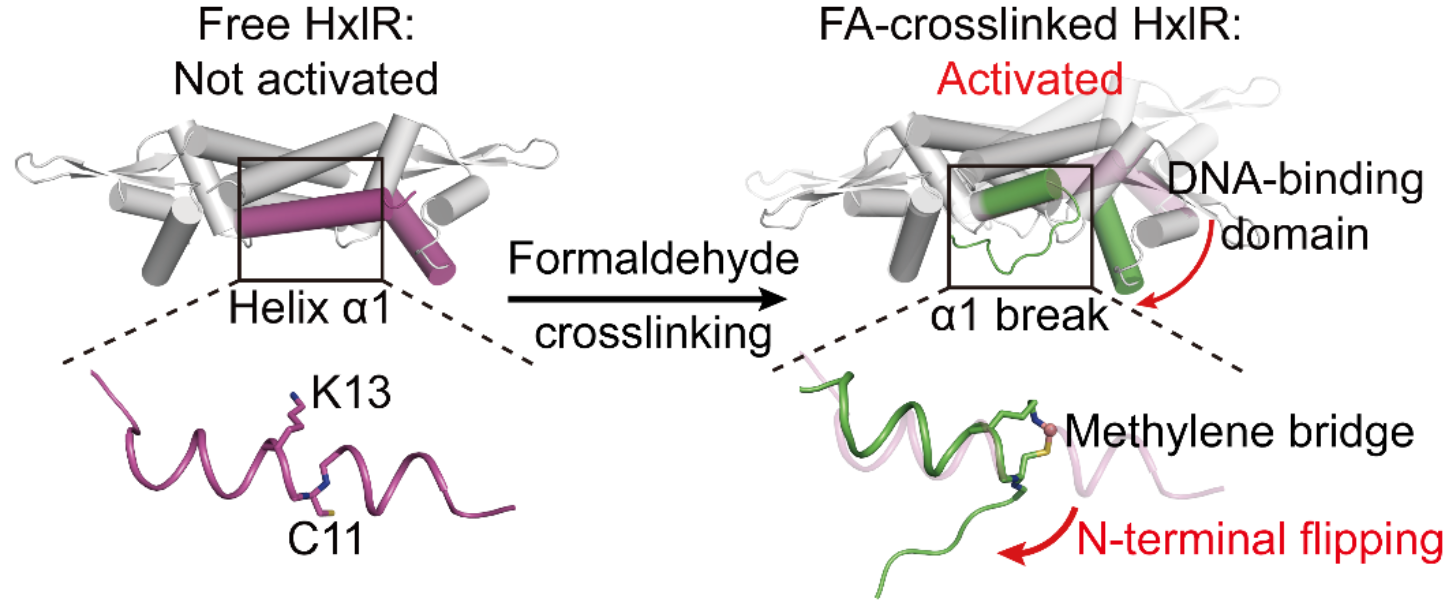
甲醛通过位点特异的亚甲基桥连激活转录因子HxlR
这一甲醛响应机制的解析进一步为研究团队提供了启示:HxlR特异性响应甲醛的构象变化可以用于设计甲醛检测的荧光探针。目前已报道的甲醛探针均为小分子探针,时空分辨率与细胞、组织特异性受到限制,难以对甲醛的细胞内分布进行精确检测。基因编码的荧光探针,在时空分辨的检测、动态检测等方面都更有优势,但鉴于甲醛响应机制研究的缺乏,难以设计基于蛋白质的探针。而HxlR蛋白相应甲醛的分子机制的解析无疑为这一问题提供了解决方案。
基于对HxlR蛋白的结构分析,研究团队向HxlR特定位点嵌入了对结构变化敏感的荧光蛋白,并通过筛选和优化,成功开发出一系列新型基因编码的甲醛荧光探针。他们首先在体外实验中对探针进行了表征。之后,研究团队利用该探针,成功进行了细胞内甲醛浓度的动态检测;通过多色荧光成像,对不同亚细胞空间下甲醛变化进行了同步检测;通过干扰甲醛代谢通路,记录了探针对胞内甲醛生理浓度变化的响应。进一步,研究团队与北京大学李毓龙课题组合作,检测了该探针在小鼠脑组织切片中对甲醛的动态响应,验证了该探针具有动物组织水平的应用潜力。
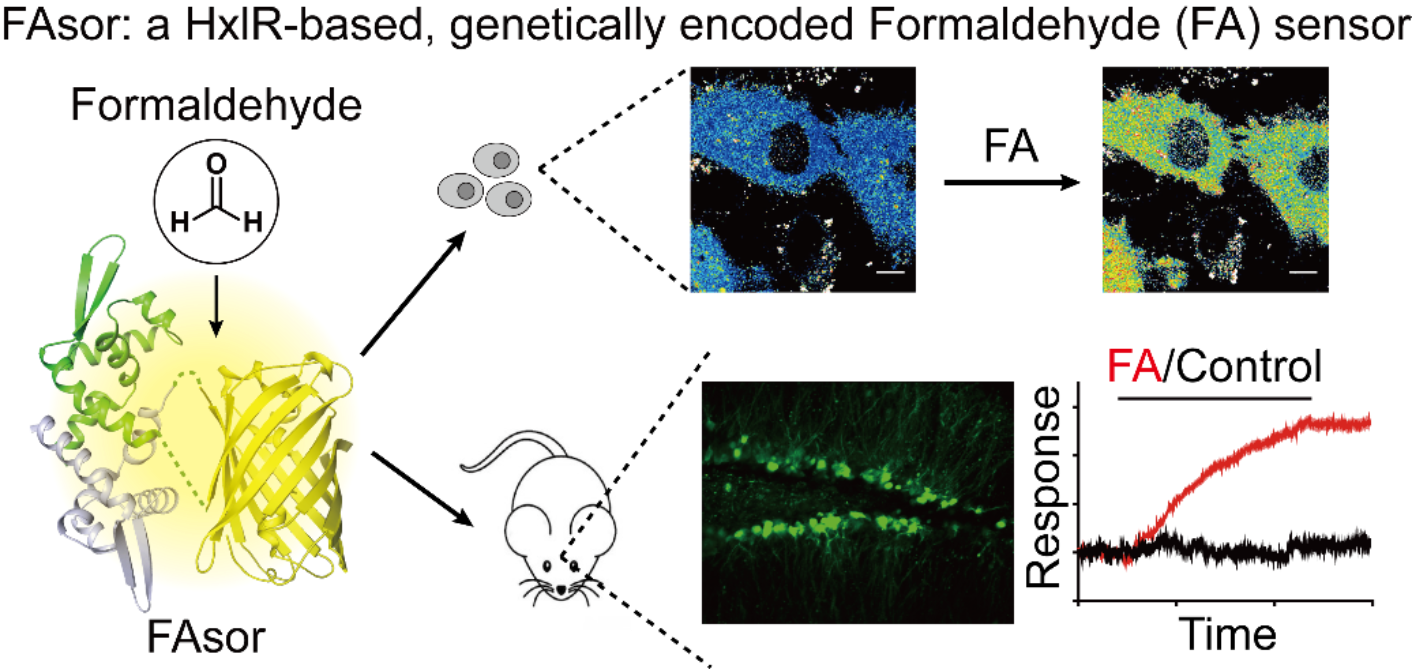
基于甲醛响应转录因子HxlR蛋白的新型甲醛探针
综上,该工作实现了对“甲醛响应”蛋白HxlR的机制解析,发现了甲醛诱导HxlR产生独特化学修饰,并由该亚甲基桥引起构象变化和激活转录调控的分子机制。受此启发,研究团队进一步开发了首个遗传编码的甲醛探针,为研究细胞内源甲醛的调控与功能提供了重要工具。
需要指出的是,本研究发现的“分子内交联”这一独特的化学修饰,可能与蛋白酰基化、烷基化等翻译后修饰类似,能够调控蛋白质的活性与功能。例如近期有研究显示,糖酵解通路的中间产物丙酮醛,可以对细胞氧化应激通路蛋白KEAP1进行“分子内交联”修饰,在邻近的精氨酸(Arg)与半胱氨酸(Cys)之间产生交联,启动下游应激响应(Bollong, M. et al. Nature, 2018, 562, 600–604)。可以预见,“分子内交联”修饰的种类、性质与功能,值得进一步探索。
陈鹏课题组2012级博士毕业生祝融峰、张功为共同第一作者;北京大学生命科学学院、生命科学联合中心李毓龙教授及其课题组2012级博士毕业生井淼完成了动物实验关键数据。该工作得到了国家自然科学基金委、科技部、北京分子科学国家研究中心以及北大-清华生命科学联合中心的资助。
论文链接:https://www.nature.com/articles/s41467-020-20754-4