Recent Highlights
Contact us
张文彬课题组
地址:北京市海淀区成府路202号
北京大学化学与分子工程学院
邮编:100871
电话:010-62766876
电邮:wenbin@pku.edu.cn

请扫以上二维码关注我们课题组的公众号。
我们将定期推送组会每周精读和泛读文献介绍以及课题组的最近新闻!
--------------------------------------------
News
摘要
近日,北京大学张文彬教授团队发展了一种新的蛋白质主动模板AT-Snoop,并将其与此前报道的主动模板AT-Spy联用,通过多组分的一步反应实现了蛋白质异质线型高阶索烃(包括[3]索烃和[5]索烃)的选择性制备。这类蛋白质的拓扑结构也通过聚丙烯酰胺凝胶电泳、尺寸排阻色谱、质谱和酶切等实验得到了证明。该工作不仅提供了新的蛋白质改造工具,也将进一步加深对于拓扑蛋白质构效关系和功能优势的深入理解。
研究背景
高分子化学的四大挑战包括对其长度、序列、立体化学与拓扑结构的精准调控。得益于高分子化学与各种精准偶联方法的发展,各种序列准确、长度可控和立体结构精准的聚合物被合成出来。然而,高分子链构象空间庞大,同时又存在众多反应活性相近的官能团,使得合成具有精确拓扑结构的高分子尤其困难。主动模板法是一种构建机械互锁分子的强力工具,它不仅能将反应组分预组装成缠结结构,同时还通过催化共价键形成来得到特定的拓扑结构。张文彬课题组将此概念引入蛋白质领域,发展了第一例蛋白质主动模板AT-Spy。通过对来源于CnaB2结构域的SpyTag/BDTag/SpyStapler复合物进行重新接线,所得环状SpyStapler能够与N/C端分别带有BDTag/SpyTag的线型蛋白质重组并形成缠结结构,随后催化异肽键形成得到异质索烃。通过对该工具的工程化,发展了效率更高的蛋白质主动模板AT-Spy003,并将其应用于构建辐射型蛋白质[n]索烃(n=3,4,5)。为了进一步挖掘主动模板在拓扑高分子合成方面的潜力,我们需要开发更多高效且相互正交的蛋白质主动模板工具,以拓展蛋白质拓扑结构的多样性。
工作亮点
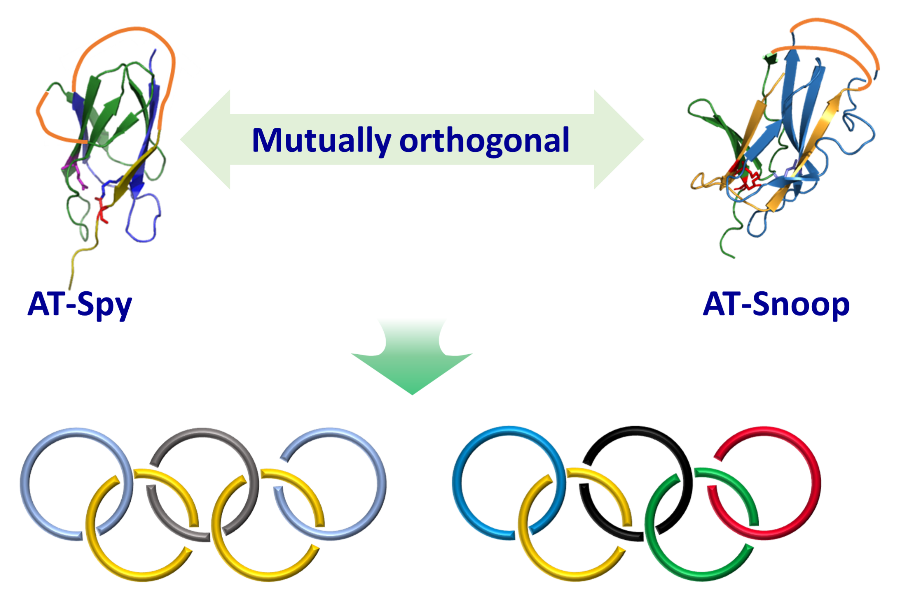
基于上述考虑,北京大学张文彬课题组通过对天然存在异肽键交联的RrgA结构域进行拆分与重新接线,得到CatTag/DogTagSr/SnoopStapler,并发展了新的主动模板工具AT-Snoop。在AT-Snoop体系里,环状的c-SnoopStapler与N端带有CatTag和C端带有DogTagSr的线型蛋白质重组形成缠结结构,随后SnoopStapler催化CatTag与DogTagSr之间异肽键的形成,得到蛋白质异质索烃。作者首先在异质[2]索烃的合成反应中验证了该设计的可行性(图1)。在二氢叶酸还原酶DHFR的两端分别融合CatTag和DogTagSr得到线型蛋白质,利用分离型内含肽的胞内环化反应得到环状催化结构域c-SnoopStapler,二者等比例混合成功制备异质索烃。值得注意的是,反应同时也给出一定比例的环状副产物c-CatTag-DHFR-DogTagSr。这可能是由于反应前尚未形成缠结结构。作者也在交叉实验中进一步验证了AT-Spy与AT-Snoop的正交反应性。这使得高阶线型索烃的简易制备成为可能(图2)。
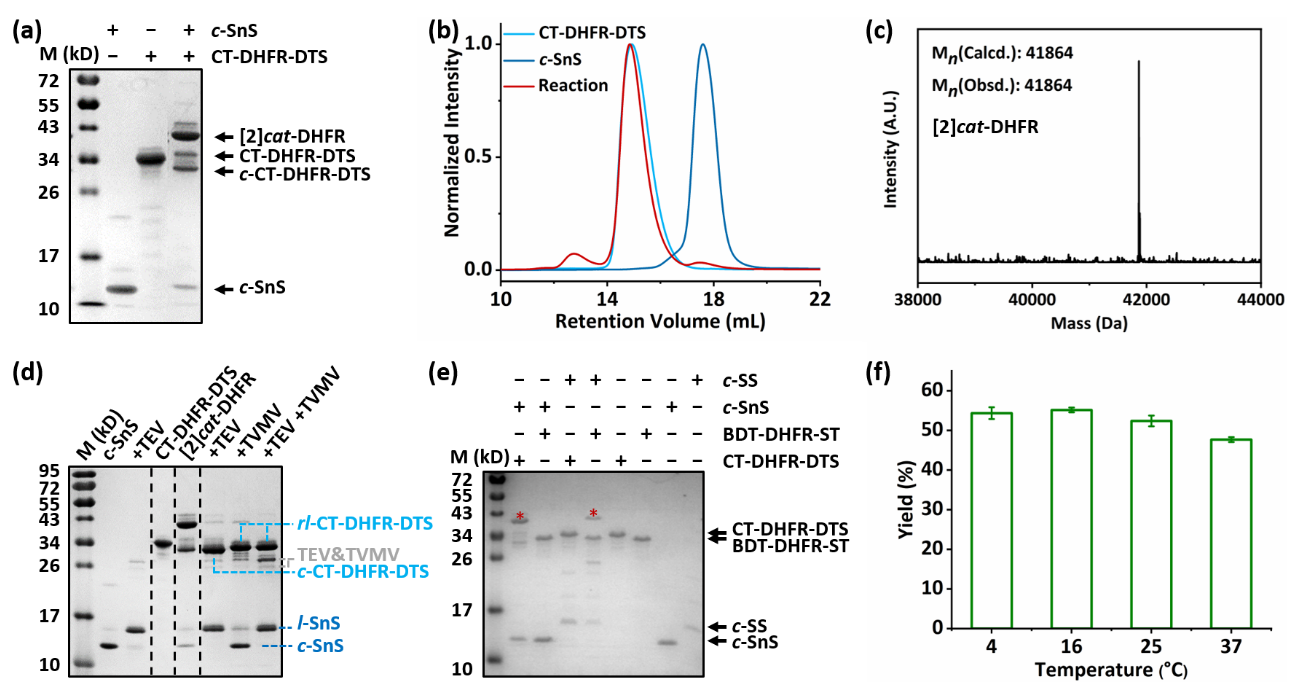
图1 AT-Snoop与AT-Spy的反应性表征
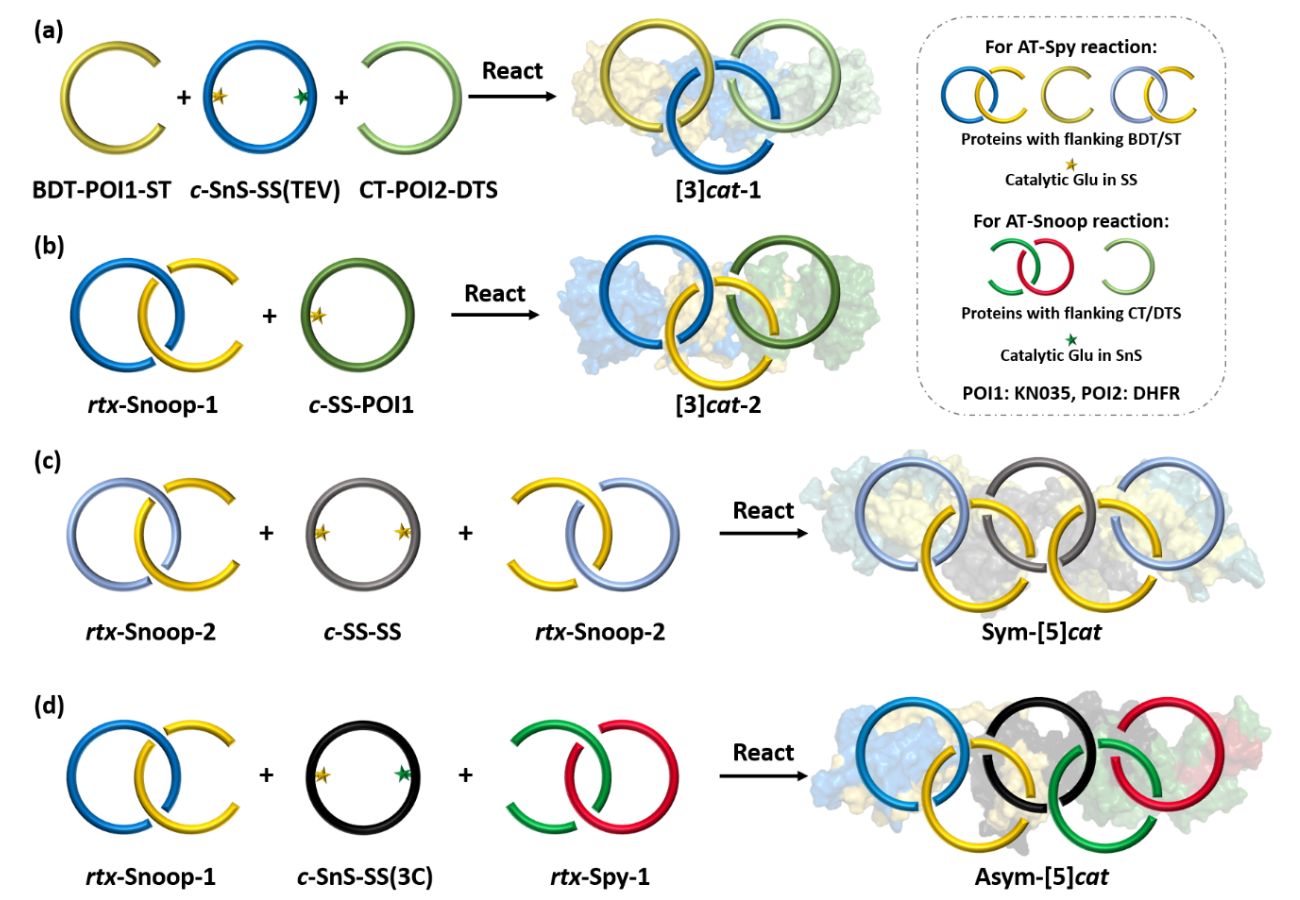
图2 基于正交主动模板的蛋白质高阶索烃的合成方法
随后,作者利用正交的主动模板通过一锅反应制备了蛋白质异质[3]索烃(图3)。利用分离型内含肽得到带有两个不同催化结构域的c-SnoopStapler-SpyStapler,将其与两个线型蛋白质BDTag-KN035-SpyTag和CatTag-DHFR-DogTagSr按等摩尔比混合,能够高选择性得到异质[3]索烃。当AT-Snoop中的SnoopStapler为线型结构时,其与CatTag-DogTagSr线型蛋白质经由细胞内AT-Snoop反应能够得到准轮烷基元rtx-Snoop-1,准轮烷轴末端的BDTag和SpyTag能够进一步与环状蛋白质c-SpyStapler-KN035通过AT-Spy反应形成另一种异质[3]索烃。准轮烷基元能够进一步简化拓扑蛋白质的制备过程,减少所需蛋白质前体数量,有利于构建更加复杂的拓扑结构。
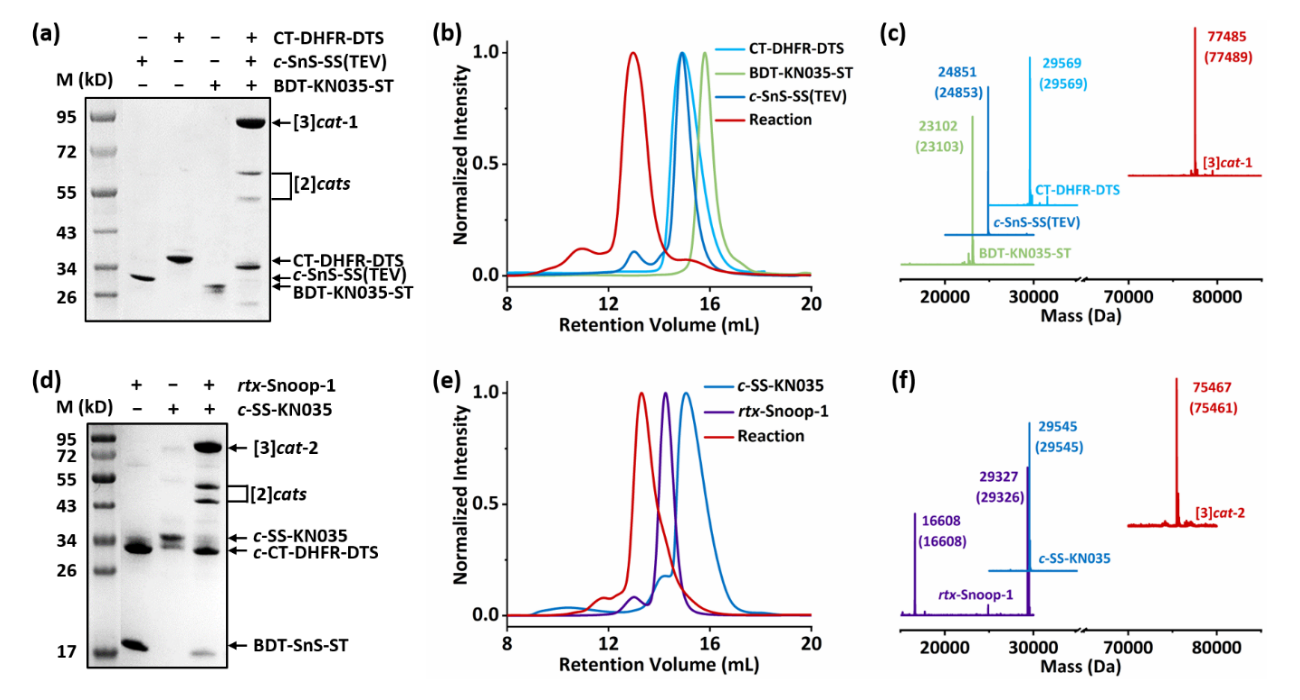
图3 两种蛋白质异质[3]索烃的合成与表征
基于在细胞内预先合成准轮烷反应基元的策略,作者进一步制备了对称奥林匹克环与不对称奥林匹克环(图2)。首先共表达两个线型蛋白质CatTag-DogTagSr和BDTag-SnoopStapler-SpyTag,二者经由AT-Snoop反应得到准轮烷rtx-Snoop-2。将其与两个SpyStapler的融合蛋白质按照2:1反应可得对称奥林匹克环,利用电泳洗脱可进一步提纯产物。不对称奥林匹克环的制备需要两种不同的准轮烷前体。将rtx-Snoop-1作为一个反应基元,另一个准轮烷rtx-Spy-1由BDTag-GFP-SpyTag与CatTag-SpyStapler-DogTagSr在细胞内经AT-Spy反应得到,将两者与c-SnoopStapler-SpyStapler等比例反应则可以制备不对称奥林匹克环。两种蛋白质奥林匹克环的产率相当,说明融合蛋白质的插入不影响本方法的反应效率(图4)。
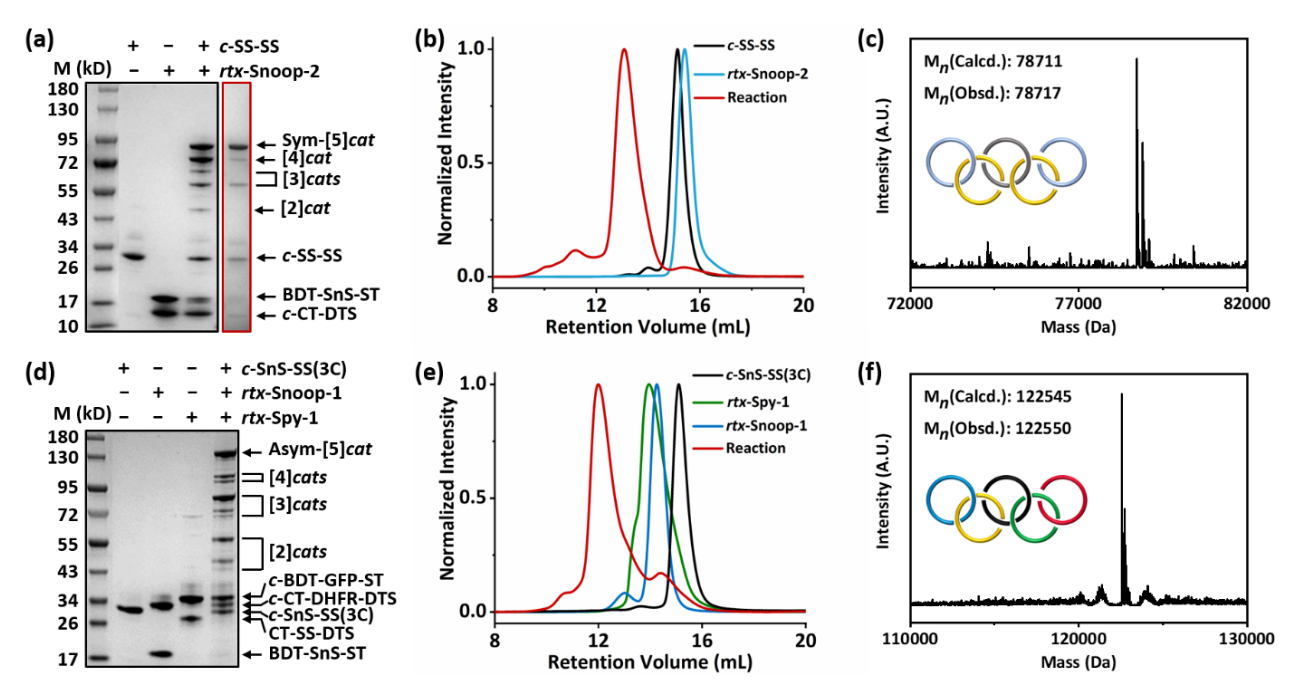
图4 蛋白质奥林匹克环的合成与表征
总结与展望
综上所述,作者发展了一种与AT-Spy相互正交的蛋白质主动模板AT-Snoop,并通过这两种工具的联用实现了蛋白质异质[3]索烃和奥林匹克环的精确合成。这些高阶索烃可以在不同位置融合多种功能蛋白质,后续有望应用到流线型催化反应、配体多价展示及分子协同变构等方面。该工作不仅为蛋白质拓扑工程提供了新的合成工具,同时也为构建高度复杂的机械互锁结构开辟了新的途径,有助于未来进一步探索与运用拓扑蛋白质的独特功能优势。
该研究近期在线发表于CCS Chem.,北京大学化学与分子工程学院博士生张凡为该论文第一作者。北京大学化学与分子工程学院刘雅杰博士和达晓娣博士也为本工作做出了贡献。北京大学化学与分子工程学院张文彬教授为通讯作者。该工作得到国家自然科学基金、国家重点研发项目和北京分子科学国家研究中心创新项目的支持。
上一篇: 北大深研院信工学院AI4S专题招生
下一篇: 北大深研院信工学院AI4S专题招生