最新热点
联系我们
张文彬课题组
地址:北京市海淀区成府路202号
北京大学化学与分子工程学院
邮编:100871
电话:010-62766876
电邮:wenbin@pku.edu.cn

请扫以上二维码关注我们课题组的公众号。
我们将定期推送组会每周精读和泛读文献介绍以及课题组的最近新闻!
--------------------------------------------
新闻中心
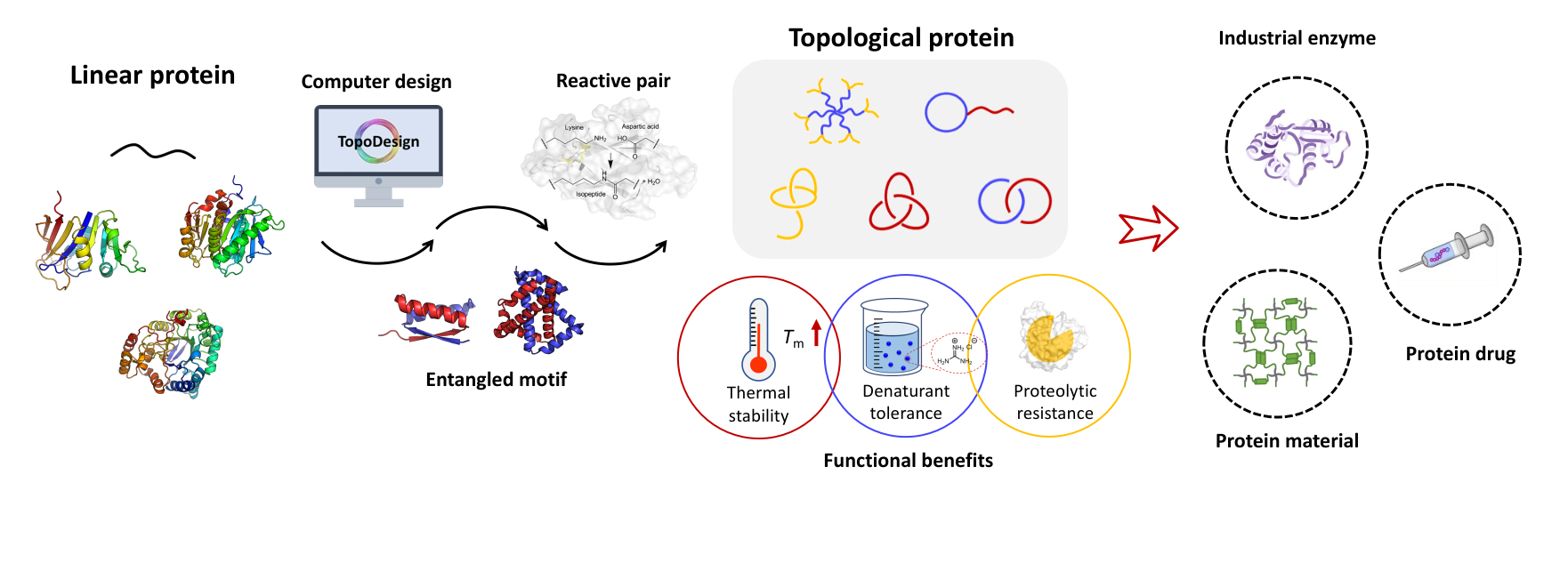
催组装在生命体内广泛存在,对许多重要生命活动起到至关作用,例如协助蛋白质折叠与组装的分子伴侣、介导核小体组装与解组装过程的组蛋白伴侣,都是典型的催组剂。生命体系中的这些复杂催组装过程往往涉及多个(催)组装与反应的连续步骤,例如噬菌体HK97衣壳的构建,就需要依次经历催组装、自组装以及后续的共价交联反应,最终才能完成完整衣壳的形成。但是这些催组装过程往往过于复杂,体系中的多重组装与反应交织在一起,使得催组装机理及催组剂的作用机制难以通过物理化学手段加以全面解析。
针对上述问题,北京大学张文彬课题组设计并构建了首个人工蛋白质催组装模型体系,通过引入分子识别与酶促连接模块,成功实现了多步组装–反应级联的简化再现,并与香港科技大学高寒宇课题组合作深入解析了该催组装体系的动力学行为,提炼了关于催组装体系的若干特征。研究团队利用 AlphaFold2 结构预测,设计了关键多肽的构象转变,提出了相应的“闸门”机制,实现了催组剂的理性构建,同时结合全参数动力学建模,对各个速率常数与平衡常数进行了系统分析,揭示了影响催组装性能的关键参数窗口,并给出了最优条件下的设计策略。实验结果显示,仅需加入0.1当量的催组剂,体系的初始速率便提升约12倍,半衰期缩短94%,显著提高了级联过程的效率。
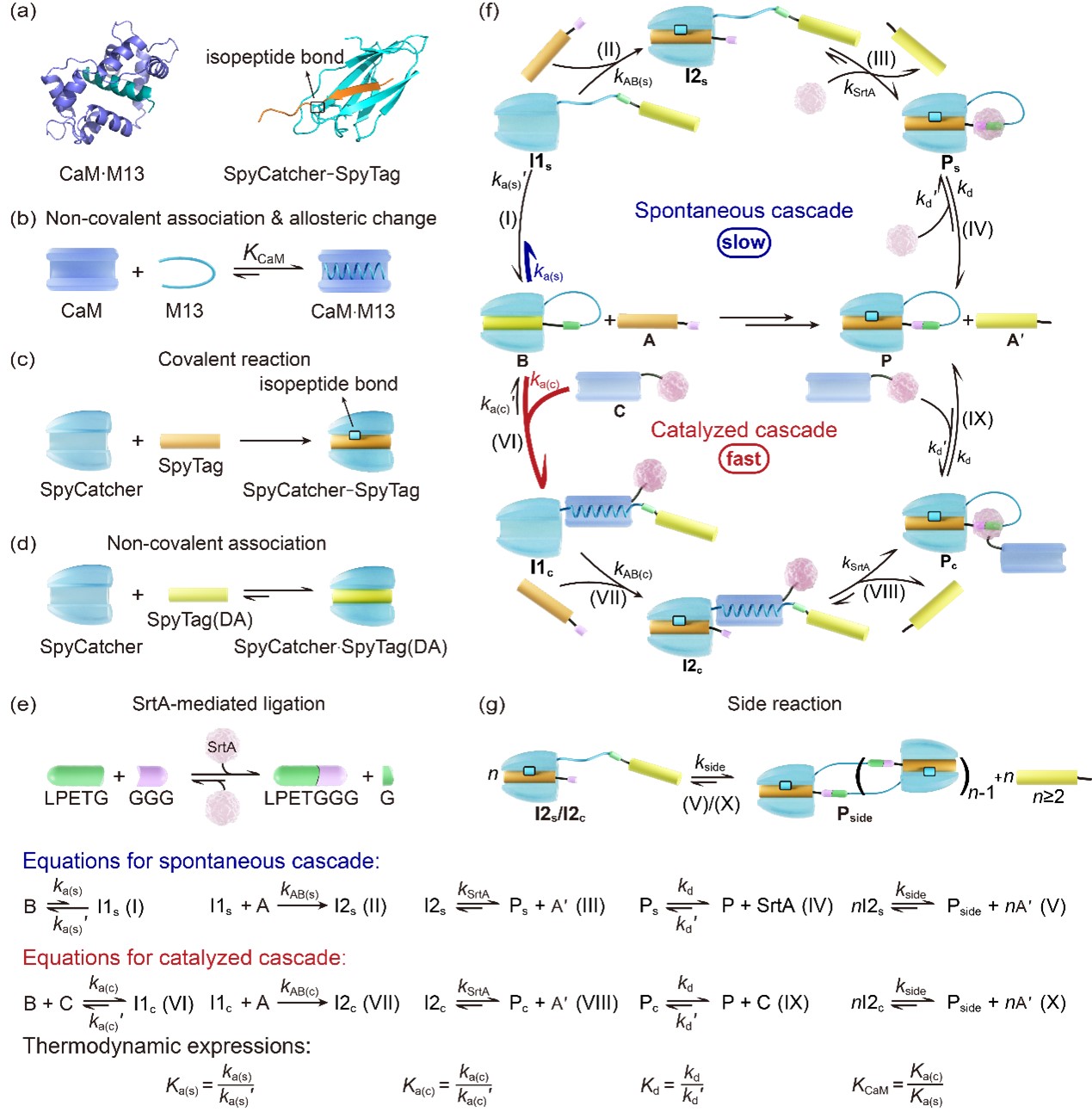
图1 蛋白质催组装模型体系的理性设计。(a) 基元CaM·M13的结构(PDB 编号:1QTX;CaM:紫色;M13:绿色)以及SpyCatcher–SpyTag 的结构(PDB 编号:4MLI;SpyTag:橙色;SpyCatcher:青色)。(b) CaM与M13之间的非共价结合及 M13 结合后发生的构象变化示意图;(c) SpyCatcher与SpyTag之间的共价反应;(d) SpyCatcher与SpyTag(DA)的非共价结合;(e) SrtA 催化的连接反应;(f) 设计的自组装级联与催组装级联;(g) 副反应。
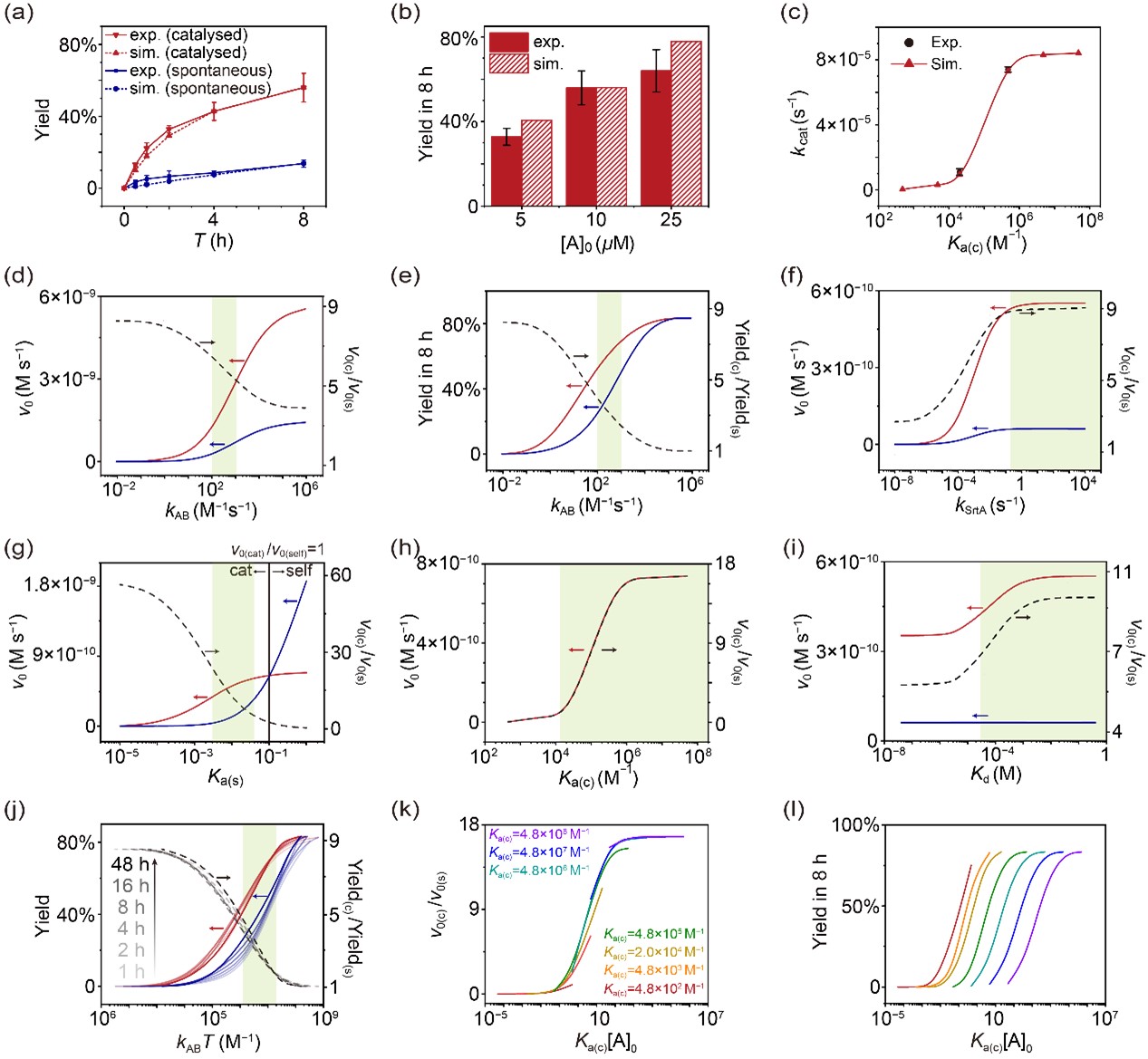
图2. 动力学建模与实验结果对比。实验数据与模拟曲线高度吻合,表明所构建的模型能够准确再现自组装与催组装的动力学过程。进一步的分析揭示,不同参数(如结合常数、反应速率常数和初始浓度)都会显著影响反应的速率和产率,为理解和优化催组装过程提供了重要依据。
研究进一步发现,催组剂可以分为“融合型”与“组合型”两种构建方式,二者各具特色:前者以紧凑的单元设计实现高效催组装和自我循环再生,适合实现多个组件之间的高度协同;后者则因组分可自由调节,具备更高的灵活性,在基元特性相对固定的前提下,可以更大范围地优化反应动力学和扩展性能窗口。这两类策略都可以通过基因编码被融入到生命体系中,其特征相辅相成,体现了不同催组剂设计思路的互补性。
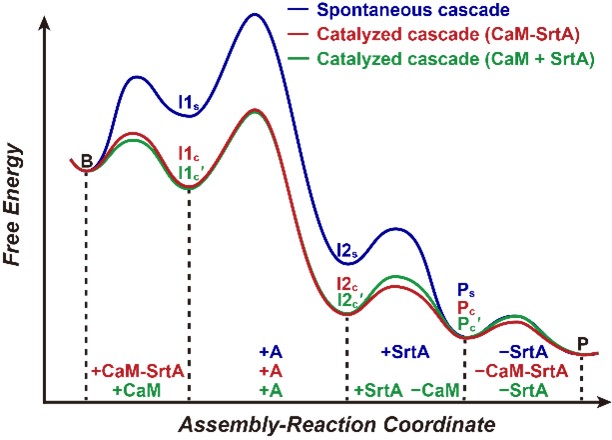
图3. 自组装与催组装级联的自由能曲线示意图。横坐标表示组装–反应级联的各个步骤,纵坐标表示相对自由能水平,用以反映各个转化过程的自发性与能量变化。蓝色曲线对应自组装,红色曲线对应使用“融合型”的催组剂,绿色线对应使用“组合型”的催组剂。不同类型的催组剂在不同阶段各有优势。
综上,该研究不仅构建了首个基于理性设计的蛋白质–多肽催组装模型体系,并通过结构预测与动力学建模系统揭示了催组剂的作用机制,还为理解生命体系中分子伴侣介导的复杂催组装过程提供了新的模型与视角。
相关成果以“Designing Catalysts to Accelerate a Protein–Peptide Assembly-Reaction Cascade”为题,已发表于 ACS Central Science,通讯作者为北京大学张文彬教授与香港科技大学高寒宇教授,第一作者为北京大学孙轶斌博士(现为吉林大学PI)。香港科技大学博士生方悦、北京大学刘雅杰博士、博士生蒋冯逸,华中师范大学雷志超博士共同协助了本研究。该工作得到国家自然科学基金委员会、国家重点研发计划、北京分子科学国家研究中心、深圳市医学研究专项资金、香港科技大学启动基金、香港研究资助局青年学者计划以及北京大学国家蛋白质科学研究中心的大力支持。
上一篇: 2025年9月课题组成立十二周年庆祝活动
下一篇: 2025年9月课题组成立十二周年庆祝活动