最新热点
联系我们
张文彬课题组
地址:北京市海淀区成府路202号
北京大学化学与分子工程学院
邮编:100871
电话:010-62766876
电邮:wenbin@pku.edu.cn

请扫以上二维码关注我们课题组的公众号。
我们将定期推送组会每周精读和泛读文献介绍以及课题组的最近新闻!
--------------------------------------------
新闻中心
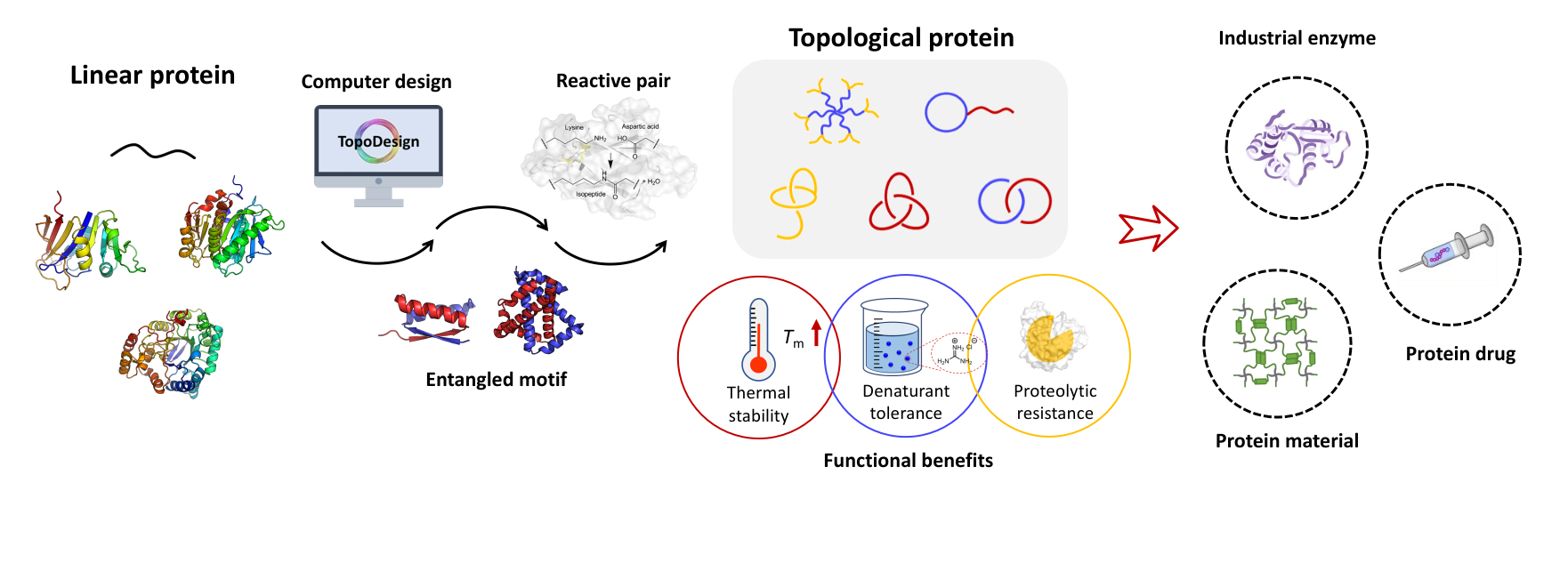
兼职蛋白质是一类可行使多种相互独立功能的蛋白质,且其多功能并不来源于融合蛋白、翻译后修饰等过程。在同个蛋白质骨架上实现多种功能是大自然中蛋白质进化的一个重要方向。然而,目前对于兼职蛋白质的研究多数局限于天然的兼职蛋白质。如何理性设计开发人工设计的兼职蛋白质是一个饶有趣味的研究方向。
近年来,可基因编码的蛋白质偶联工具获得了极大的丰富和发展,并在拓扑蛋白质的高效生物合成、多价抗体的设计以及功能生物材料的制备等方面取得了广泛的应用。谍捕手-谍标签反应对被认为是多肽-蛋白反应对的“金标准”,对其进行改造可大大丰富其功能性质。张文彬课题组以谍捕手为原型,通过对谍捕手表面的氨基酸进行定点突变,实现其超电荷化,得到了带有21个正电荷的超正谍捕手,每千道尔顿单位质量电荷高达+1.67。在如此高的正电荷密度下,超正谍捕手仍保持着与谍标签的反应性,反应具有随温度、pH的刺激响应性。该反应可被用于在原核表达时原位构建环状的目标蛋白质(如绿色荧光蛋白和核糖核酸酶),而超正谍捕手较高的正电荷密度也赋予了其递送目标蛋白质进细胞的能力。结果表明以超正谍捕手所递送的核糖核酸酶仍保留有核糖核酸酶的细胞毒性,其IC50低达0.24 μM,显示出了超正谍捕手高效的递送能力。另外,利用正负电荷之间的静电相互作用,超正谍捕手能与带有负电荷的质粒发生相分离行为,形成凝聚物液滴。超正电荷谍捕手的反应性、蛋白递送能力以及与核酸的相分离三种功能相互独立,因此它可以被认为是一种人工设计的兼职蛋白质。该工作再次展示了谍捕手-谍标签结构丰富的可设计性,以及利用超正电荷策略发展兼职蛋白质的巨大潜力。
该研究近期在线发表于CCS Chemistry。北京大学化学与分子工程学院博士生杨婷婷为该论文第一作者。北京大学化学与分子工程学院张文彬教授为论文通讯作者。北京大学第三医院的彭荣梅博士也为该工作做出了重要贡献。该工作得到了北京分子科学国家研究中心,科技部国家重点研发计划、国家自然科学基金的资助。