近日,北京大学化学与分子工程学院、北大-清华生命科学联合中心陈鹏教授课题组以“Enzyme-Mediated Intercellular Proximity Labeling for Detecting Cell–Cell Interactions”为题在J. Am. Chem. Soc.杂志报道了一种能够在活体和原位情况下捕获细胞之间相互作用的技术;美国化学会C&E NEWS于2月12日以“New labeling method can reveal cell-cell interactions”为题进行了专题报道。
不同细胞之间的相互作用和信息传递在包括免疫响应、器官发育、神经传导在内的众多生命活动中都扮演着关键角色。目前,研究细胞互作的方法大都需要已知参与的细胞类型,难以在复杂的活体环境下发现或研究未知的细胞间相互作用。为了解决这一难题,陈鹏课题组借助“定向进化”技术和“邻近标记”策略,实现了细胞之间动态相互作用的原位捕获。这一被命名为EXCELL(Enzyme-mediated proximal cell labeling)的技术,通过将作者定向进化得到的分选酶(mgSrtA)展示在待研究的细胞表面,能够对与其相互作用的细胞进行原位捕获与鉴定,为研究细胞-细胞相互作用提供了有力的工具。
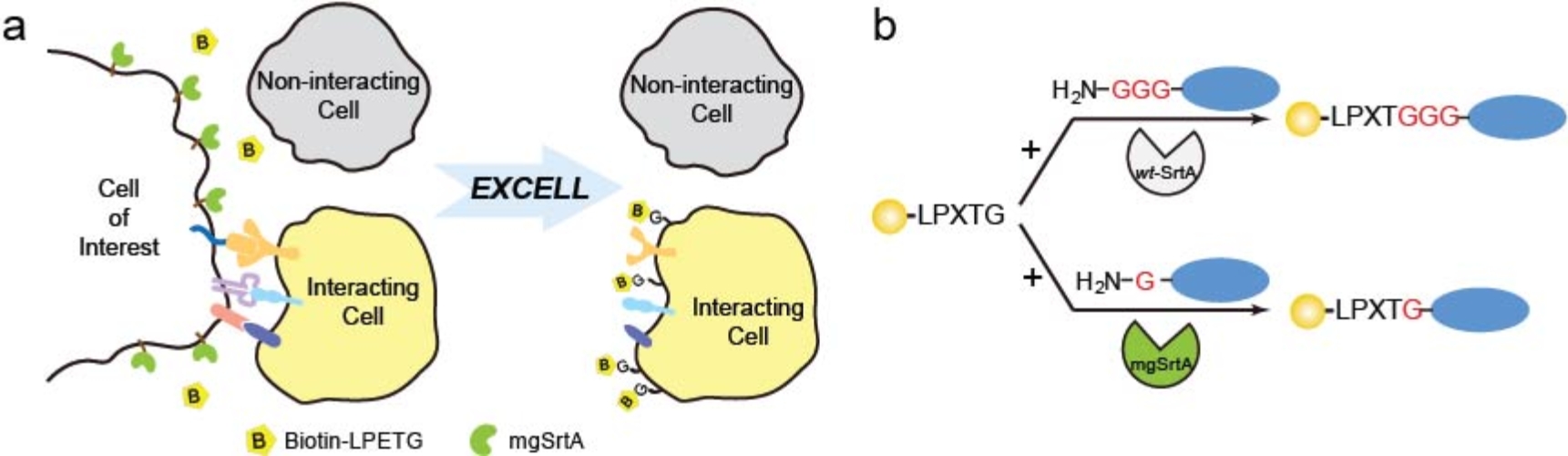
图 1 EXCELL方法用于捕获和鉴定细胞间相互作用
源自金黄色葡萄球菌的分选酶Sortase A (SrtA)能够催化分选肽(LPETG)和寡聚甘氨酸的共价连接。近期有文献报道将SrtA用于监测小鼠体内特定受体-配体介导的免疫细胞互作过程1。但是该方法需要将SrtA与寡聚甘氨酸分别融合在相互作用的配体和受体细胞上,因此需要预知相互作用的细胞类型,并对两类细胞同时进行基因改造,因此无法捕捉未知的细胞间相互作用。为了突破这一瓶颈,陈鹏课题组设想获得一种针对未知细胞的标记方法。由于细胞表面蛋白中有大约5%含有N端单一甘氨酸,受此启发,他们希望获得一种对单个甘氨酸的N端氨基进行标记的分选酶,从而能够对任意细胞加以标记。为此他们建立了对SrtA进行定向进化的高通量荧光筛选平台,并成功获得了对单一甘氨酸进行标记的高活性SrtA突变体-mgSrtA,能够实现对任意细胞类型的有效标记。
作者分别借助亲和体-抗原(ZHER与Her2)和配体-受体(CTLA4与B7, CD40L与CD40)的相互作用来验证该方法的可靠性。实验证明展示在细胞表面的mgSrtA可借助邻近效应,将含有 biotin标签的分选肽biotin-LPETG共价标记在与其相互作用的细胞表面。通过流式细胞术检测,能够发现biotin标记信号仅在相互作用细胞上有显著性增强,由此可成功区分和捕获发生相互作用的细胞。
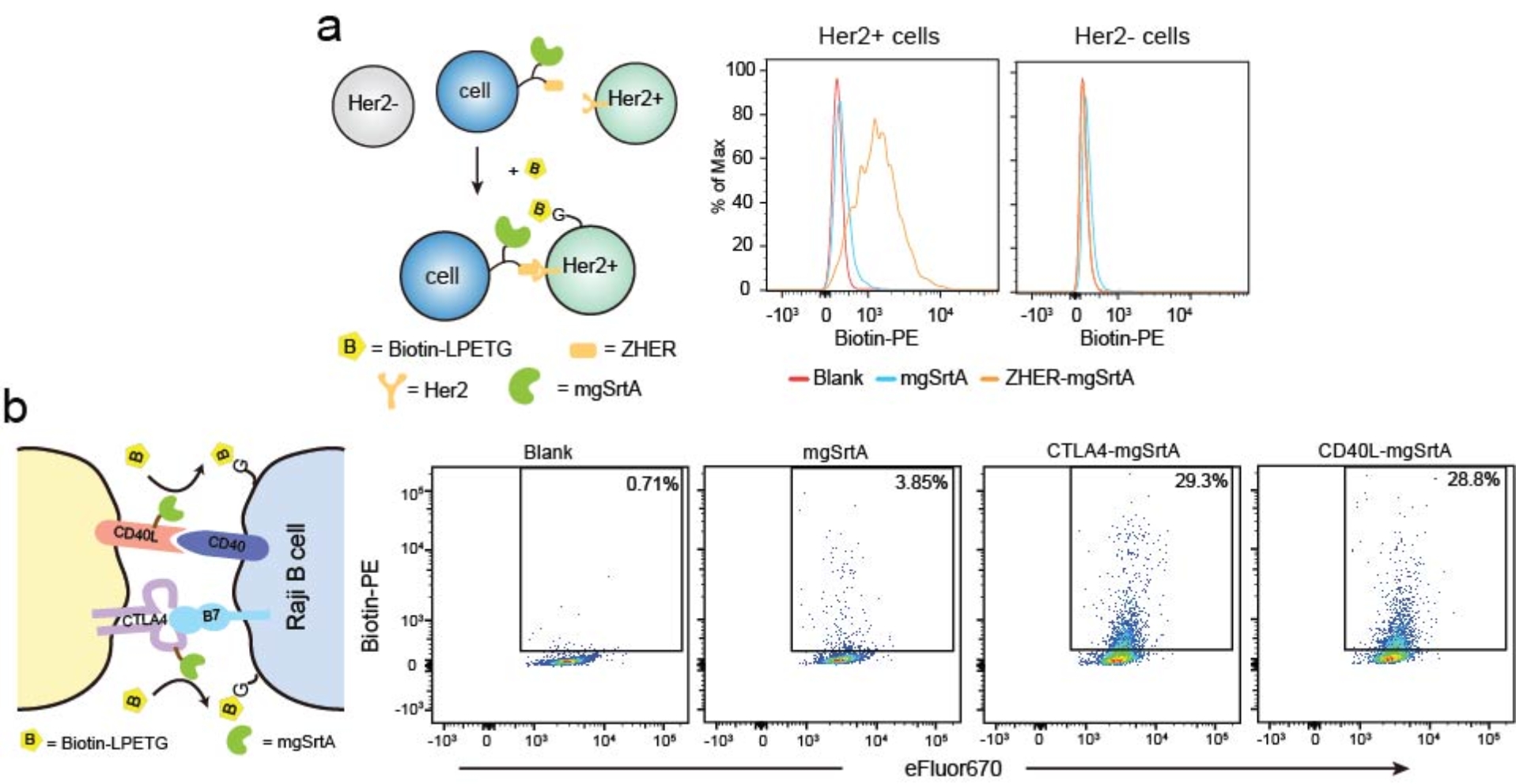
图 2在两类细胞相互作用模型上应用EXCELL,可实现对互作细胞的有效标记
该方法首次将SrtA改造成高活性且具有更宽泛底物谱的“邻近标记”酶,并验证其对细胞相互作用的标记和追踪。文中指出,EXCELL方法无需将寡聚甘氨酸事先引入到对象细胞表面,因此适用于研究复杂体系中未知细胞类型的相互作用。同时,鉴于SrtA底物分选肽仅含五个氨基酸,并已成功应用于小鼠体内。该标记方法不仅易于监测,在未来还可以与多种下游分析平台兼容,完成对相互作用细胞的捕获、富集和测序,从而进一步得出细胞间相互作用在时间、空间、类型等多方面的信息。
近年来,一系列蛋白质邻近标记技术被开发并应用于蛋白质组学研究, 此次开发的EXCELL技术实现了细胞互作的原位标记与捕获,将邻近标记策略从“胞内”拓展至“胞外”空间,将在免疫应答、神经传导等领域具有广阔的应用前景。陈鹏教授为该论文的通讯作者,课题组博士毕业生葛韵、陈龙为共同第一作者。该工作得到了国家自然科学基金委、科技部和北京大学合成与功能生物分子中心的资助。
原文链接:
https://pubs.acs.org.ccindex.cn/doi/10.1021/jacs.8b10286
C&E NEWS链接:
https://cen.acs.org/biological-chemistry/biochemistry/New-labeling-method-reveal-cell/97/web/2019/02